高考第一轮氧族元素复习
一、选择题(本题包括9个小题,每小题有一个选项符合题意,共45分)
1.硒是氧族元素,下列关于硒及其化合物的叙述,不正确的是
A.硒化钠的熔点较高 B.硒难溶于水
C.硒化氢不能与二氧化硫反应 D.硒化氢有毒
解析:根据氧族元素递变规律,可知硒化氢和SO2能发生反应:2H2Se+SO2====2Se+S+2H2O。故C选项符合题意。由Na2O、Na2S熔点较高可推测Na2Se熔点也较高,由H2S有毒可推测H2Se也有毒,由S难溶于水可知单质硒亦难溶于水。故A、B、D三项不符合题意。
答案:C
2.下列气体中,若空气中含有微量时能使人产生爽快和振奋的感觉,但稍多时就会对人体,动、植物等造成危害的是
A.CO2 B.SO2 C.O3 D.O2
解析:空气中微量臭氧能刺激中枢神经,加速血液循环,令人产生爽快和振奋的感觉,但空气中臭氧的含量超过10-5%时,会对人,动、植物造成危害。而SO2只刺激呼吸系统,对呼吸系统造成危害。
答案:C
3.下列有关硫的说法正确的是
A.硫可溶于水
B.硫易溶于二硫化碳
C.硫单质在与Cu、Fe、O2的反应中均作氧化剂
D.硫在自然界中仅以化合态存在
解析:硫不溶于水,所以A不正确。S与O2反应时生成SO2,硫作还原剂,所以C不正确。硫在自然界中主要以黄铁矿(FeS2)、黄铜矿(CuFeS2)等化合物形式存在,但在自然界中也存在单质硫,也叫自然硫,所以D不正确。硫易溶于二硫化碳中,所以B正确。
答案:B
4.下列现象说明SO2具有氧化性的是
A.SO2通入品红溶液中使之褪色
B.SO2通入KMnO4酸性溶液中使之褪色
C.SO2通入溴水中使之褪色
D.SO2通入饱和H2S溶液中析出浅黄色沉淀
解析:SO2具有漂白性、氧化性、还原性。A中表现出漂白性,B、C中表现出还原性,只有D中(2H2S+SO2====3S↓+2H2O)表现出SO2的氧化性。
答案:D
5.向50 mL 18 mol·L-1的H2SO4溶液中加足量铜片并加热,充分反应后,被还原的H2SO4的物质的量为
A.小于0.45 mol B.等于0.45 mol
C.在0.45~0.90 mol之间 D.大于0.90 mol
解析:由反应式Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,可知当H2SO4完全反应时,被还原的H2SO4的物质的量应为0.45 mol,但事实上H2SO4不可能完全反应(溶质减少,生成物中有水,H2SO4溶液变稀),故被还原的n(H2SO4)<0.45 mol。
CuSO4+SO2↑+2H2O,可知当H2SO4完全反应时,被还原的H2SO4的物质的量应为0.45 mol,但事实上H2SO4不可能完全反应(溶质减少,生成物中有水,H2SO4溶液变稀),故被还原的n(H2SO4)<0.45 mol。
答案:A
6.储存浓H2SO4的铁罐外口出现严重的腐蚀现象,这体现了浓硫酸的
A.吸水性和酸性 B.脱水性和吸水性
C.强氧化性和吸水性 D.不挥发性和酸性
解析:铁遇冷的浓硫酸会发生钝化,但浓硫酸具有较强的吸水性,吸水后变为稀硫酸,与活泼金属发生置换反应。
答案:A
7.下列情况可能引起水污染的是
①农业生产中农药、化肥使用不当 ②城市生活污水的任意排放 ③原子核反应的残留物随意排放 ④海上油轮石油泄漏⑤工业生产中废气、废液、废渣排放不当
A.①②③⑤ B.①③④⑤ C.①②③④ D.全部都是
解析:农药、化肥使用不当,城市生活污水的任意排放,海上油轮石油泄漏等皆可引起水污染。核反应的残留物会引起土壤和水污染,工业生产中的废气、废液、废渣的排放,可同时引起大气、水和土壤等污染。
答案:D
8.(2005年全国名校联考模拟题)我国三峡工程所提供的清洁、廉价、强劲、可再生的水电,相当于每年燃烧3000万吨原煤的火力发电厂产生的电能,因此,三峡工程有助于控制
①温室效应 ②二氧化硫的排放 ③白色污染 ④碳氢化合物的排放
A.①② B.①②③ C.①②④ D.①②③④
解析:煤燃烧会产生大量的CO2和SO2气体,用水代煤发电可控制CO2和SO2的排放。
答案:A
9.(2005年威海模拟题)清晨,松树林中的空气格外清新,是因为有极少量的氧气能够变成臭氧(O3),反应的化学方程式为:3O2====2O3。下列有关说法正确的是
A.这是一个化合反应
B.产生的臭氧可以填充“臭氧空洞”
C.这是一个氧化还原反应
D.产生的臭氧与氧气是氧的同素异形体
解析:由同种元素形成的不同单质互称同素异形体。此反应为同素异形体间的相互转换,反应类型既不是化合也不是氧化还原反应,且无论从O3的生成量或在大气中的位置看,都不涉及“臭氧空洞”。
答案:D
二、非选择题(本题包括5个小题,共55分)
10.(10分)我国劳动人民早在4000多年前就已用一种朱红色的颜料W,请根据下列实验事实确定组成W的两种元素,并填空:
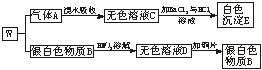
(1)W的组成元素是_______、_______。
(2)A![]() C的化学方程式_______________。
C的化学方程式_______________。
(3)使用朱红颜料W不慎会使人中毒的原因是_________________。
解析:在C溶液中加BaCl2与HCl溶液得白色沉淀E,知C中含有SO![]() ,故A气体为SO2;又银白色物质B可溶于HNO3,且所得溶液与Cu作用又得B,故B为Hg。所以W的组成元素为Hg、S。由于HgS为重金属盐,可使蛋白质变性,故会使人中毒。
,故A气体为SO2;又银白色物质B可溶于HNO3,且所得溶液与Cu作用又得B,故B为Hg。所以W的组成元素为Hg、S。由于HgS为重金属盐,可使蛋白质变性,故会使人中毒。
答案:(1)Hg(2分) S(2分)
(2)Br2+SO2+2H2O====H2SO4+2HBr(3分)
(3)HgS为重金属盐,能使蛋白质(凝聚)变性(3分)
11.(11分)如图所示:
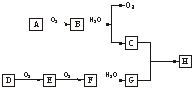
在上述转化关系中,已知B、D都是淡黄色固体,且A与D可反应生成离子化合物。回答:
(1)写出下列物质的化学式A._______,F._______,H._______。
(2)写出C的电子式_______。
(3)写出B![]() C、E
C、E![]() F的化学方程式。
F的化学方程式。
解析:常见的淡黄色固体有S、Na2O2、AgBr等,由B与水反应产生O2可知B为Na2O2,C为NaOH。D与O2反应生成E,E与O2继续反应生成F,且D与A生成离子化合物可知,D为S,E为SO2,F为SO3,G为H2SO4,H为Na2SO4。
答案:(1)Na(1分) SO3(1分) Na2SO4(1分) (2)Na+[∶![]() ∶H]-(2分)
∶H]-(2分)
(3)2Na2O2+2H2O====4NaOH+O2↑(3分)
2SO2+O2![]() 2SO3(3分)
2SO3(3分)
12.(13分)有a、b、c三种常见的短周期元素,它们之间两两结合构成化合物X、Y、Z,X、Y、Z之间也能相互发生反应。已知X是由a和b元素按原子个数比1∶1组成的化合物,a、b、c元素形成的单质(仍用a、b、c表示)和由它们组成的化合物之间的反应关系如下(未配平):
①b+c![]() Y ②a+c
Y ②a+c![]() Z ③X+Y
Z ③X+Y![]() m ④X+Z
m ④X+Z![]() c+n ⑤Y+Z
c+n ⑤Y+Z![]() c+n
c+n
(1)上述反应中,有最充分理由说明该反应一定属于氧化还原反应的是_________(填反应编号)。
(2)如果m是一种无色黏稠油状液体化合物,则X、Y、Z的化学式分别是_________、_________、_________。
(3)③反应的化学方程式是_______________。
(4)④反应的化学方程式是_______________。
解析:本题考查了氧化还原反应与基本反应类型的关系及物质的推断。作为推断题,找到“题眼”或“突破口”非常关键。本题对m的推测是解题的突破口,利用假设论证法可顺利解出此题。根据题干信息,m是无色黏稠油状液体化合物,可假设它是浓H2SO4,再进一步论证。按题给信息倒推:X、Y为SO3和H2O。但这与题中所述X中a∶b=1∶1相矛盾。假想X为H2O,则Y为SO2。H2O2有氧化性,SO2有还原性,两者反应生成H2SO4也是合理的。
由此可得的:a为H,b为O,c为S。
由b+c![]() Y得O2+S
Y得O2+S![]() SO2 Y为SO2
SO2 Y为SO2
由a+c![]() Z得H2+S
Z得H2+S![]() H2S Z为H2S
H2S Z为H2S
由X+Y![]() m得H2O2+SO2
m得H2O2+SO2![]() H2SO4
H2SO4
由X+Z![]() c+n得H2O2+H2S
c+n得H2O2+H2S![]() S+H2O
S+H2O
由Y+Z![]() c+n得SO2+H2S
c+n得SO2+H2S![]() S↓+H2O
S↓+H2O
有单质参加的化合或分解反应肯定为氧化还原反应,可推知①②④⑤是氧化还原反应。
答案:(1)①②④⑤(3分)
(2)H2O2 SO2 H2S(各2分)
(3)H2O2+SO2====H2SO4(2分)
(4)SO2+2H2S====3S↓+2H2O(2分)
13.(9分)一氧化氮是大气污染物之一。目前,有一种治理的方法是在400 ℃左右,在催化剂存在的情况下,用氨把一氧化氮还原为氮气和水,请写出该反应的化学方程式:_____________________________________。有人设想用天然气替代NH3处理NO,①如能,请写出相关的化学方程式:____________________________________,并指出采用这一方案的优点:____________________;②如不能,请说明原因:_____________________。
解析:用化合价升降法配平NH3与NO反应的化学方程式:![]() +
+![]()
![]() 5N2+
5N2+
6H2O。天然气的主要成分是CH4,CH4的还原性强于NH3,则CH4可与NO发生如下反应:4NO+CH4====CO2+2N2+2H2O,本方案的优点是相同质量的CH4和NH3还原NO,CH4还原的NO多且天然气资源丰富,可使生产成本降低。
答案:4NH3+6NO![]() 5N2+6H2O(3分) CH4+4NO
5N2+6H2O(3分) CH4+4NO![]() 2N2+CO2+2H2O(3分) 相同质量的CH4和NH3还原NO,CH4还原的NO多且天然气资源丰富,大大降低了生产成本(3分)
2N2+CO2+2H2O(3分) 相同质量的CH4和NH3还原NO,CH4还原的NO多且天然气资源丰富,大大降低了生产成本(3分)
14.有点难度哟!
(12分)一包重41.6 g的固体样品,其成分是硫和铁的化合物,将它充分煅烧后,硫和铁分别被氧化成SO2和Fe2O3,其中SO2在标准状况下为13.44 L。试求:
(1)样品中硫元素与铁元素的物质的量之比。
(2)样品化合物的成分是什么?
(3)样品中化合物的物质的量为多少?
解析:(1)n(SO2)=![]() =0.6 mol,41.6 g样品中含铁的质量为m(Fe)= 41.6 g-0.6 mol×32
g·mol-1=22.4 g,n(Fe)=
=0.6 mol,41.6 g样品中含铁的质量为m(Fe)= 41.6 g-0.6 mol×32
g·mol-1=22.4 g,n(Fe)=![]() =0.4 mol,n(S)∶n(Fe)=0.6
mol∶0.4 mol=3∶2。
=0.4 mol,n(S)∶n(Fe)=0.6
mol∶0.4 mol=3∶2。
(2)因1∶1<3∶2<2∶1,故该样品为FeS和FeS2的混合物。
(3)设FeS、FeS2的物质的量分别为x、y,则有
![]()
![]()
答案:(1)3∶2(3分)
(2)FeS和FeS2(3分)
(3)FeS为0.2 mol(3分),FeS2为0.2 mol(3分)