高考化学冲刺训练(6)
1、重庆市天原化工厂今年4月16日发生特大氯气泄漏和三氯化氮爆炸事故,造成多人死亡和失踪。已知三氯化氮分子结构与氨相似,下列有关说法不正确的是
A、消除储气罐上空泄漏出的高浓度氯气,可喷洒碱液
B、发生氯气泄漏时,附近人员可用浸有碳酸钠溶液的毛巾捂住鼻孔进行自我保护
C、氯气能腐蚀金属及非金属材料,这种腐蚀主要属于电化腐蚀
D、三氯化氮分子是极性分子
2、欲观察环己烯是否会使酸性的高锰酸钾溶液褪色,先将环己烯溶于适当的溶剂,再慢慢滴入0.005mol/L的KMnO4溶液并不断振荡。试问下列哪种溶剂最适合用来溶解环己烯以进行此实验
A 四氯化碳 B 酒精 C 氯仿 D 水
3.下列实验中用错试剂的是
A.用稀盐酸清洗做焰色反应的无锈铁丝 B.用乙酸乙酯萃取碘水中的碘
C.用稀氨水洗去残留在试管壁上的银 D.用碱石灰吸收氨气中的水蒸气
4、将2molNaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应,排出气体,得到固体。对所得固体进行测定,证明不含有Na2O2 ,则最后所得固体的物质的量为
A 1~2mol之间 B 1~4mol之间 C 2~4mol之间 D 大于4mol
5、用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.用惰性电极电解0.1mol/LNaOH时,每转移1mol电子,生成11.2L的H2
 B.标准状况下的22.4L辛烷完全燃烧,生成的二氧化碳的分子数目一定为8NA
B.标准状况下的22.4L辛烷完全燃烧,生成的二氧化碳的分子数目一定为8NA
C.6.4 gS6与S8的混合物中所含S原子数一定为0.2 NA
D.标准状况下,2.24 L氧单质所含原子数一定为0.2 NA
6、下列反应的离子方程式不正确的是
A.溴化亚铁溶液中通入过量氯气:2Fe2++2Br—+2C12==2Fe3++Br2+4C1—
B.草酸和少量烧碱溶液:H2C2O4+OH—==HC2O4—+H2O
C.漂白粉溶液吸收过量的二氧化碳:ClO—十H2O+CO2==HClO+HCO3—
D.金属铝溶于氢氧化钠溶液 Al+2OH- = AlO2-+ H2 ↑
7.如右图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜,一段时间后停止通
电,A池D极产生的气体在标准状况下为2.24 L。下列说法正确的是
A.A池为电解池,B池为原电池
B. D电极与E电极都发生氧化反应
C.F极是以粗铜板为材料作阳极
D.B池中E极质量增加25.6 g
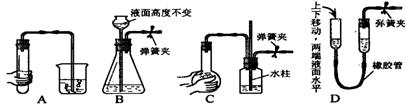
8、下列各图所示装置的气密性检查中,漏气的是
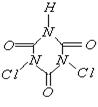
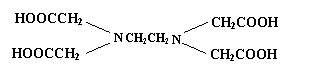 9、据世界卫生组织调查,缺铁性贫血是世界上最流行的营养性问题,一个简单的办法即是在普通酱油中加入无铁腥味、极易被人体吸收的添加剂——EDTAFeNa,其中EDTA结构(如下左图),酱油生产以后的废水可用物质绿色消毒剂(消毒后无公害)X(如下右图)来杀菌。
9、据世界卫生组织调查,缺铁性贫血是世界上最流行的营养性问题,一个简单的办法即是在普通酱油中加入无铁腥味、极易被人体吸收的添加剂——EDTAFeNa,其中EDTA结构(如下左图),酱油生产以后的废水可用物质绿色消毒剂(消毒后无公害)X(如下右图)来杀菌。
下列说法正确的是
A、1mol EDTA能与4mol NaOH发生反应
B、可用分液漏斗从铁强化酱油中分离出EDTAFeNa
C、EDTA和X在一定条件下均能发生水解反应
D、X起氧化杀菌作用的可能是其水解产物次氯酸
10、已知某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其它离子使中心原子最外层达到饱和结构的形式,如硼酸在水中可用方程式表示为:①H3BO3 + H2O ![]() [B(OH)4]- + H+;②铍的化合物间可发生以下反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓。则以下推断中正确的是
[B(OH)4]- + H+;②铍的化合物间可发生以下反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓。则以下推断中正确的是
A 、BeCl2溶液pH<7,将其蒸干、灼烧后可得残留物BeCl2
B 、Na2BeO2溶液pH>7,将其蒸干、灼烧后可得残留物Na2BeO2
C 、Be(OH)2和B(OH)3均是两性氢氧化物,且硼酸可视为三元酸
D 、硼酸加入水中后可促进水的电离
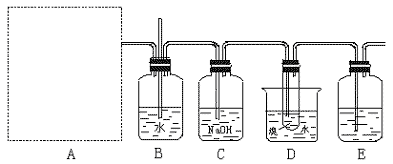 11.实验:下图为实验室用乙烯与液溴作用制取1,2—二溴乙烷的部分装置图,
11.实验:下图为实验室用乙烯与液溴作用制取1,2—二溴乙烷的部分装置图,
1,2—二溴乙烷的主要物理性质是
| 熔点 | 沸点 | 密度 | 溶解性 |
| 9.79℃ | 131.4℃ | 2.18g·cm-3 | 难溶于水易溶于醇醚等 |
(1)试在方框内画出乙烯的发生装置图。
(2)B、D中都盛有水,这两个装置的作用分别是 、
。
(3)C和E装置都盛有NaOH溶液,它们的作用是
(4)写出以乙醇、浓硫酸、液溴为主要原料生成1,2—二溴乙烷的主要化学反应方程式 。
12.如下图,已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为单质。下图中部分反应产物已略去。
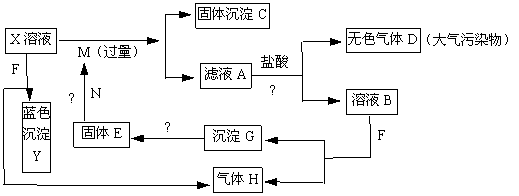
(1)X的化学式为 ;F的电子式为 。
(2)反应①的离子方程式为_______________________________________________。
反应②的化学方程式为_______________________________________________。
(3)若向100 mL 盐X的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体C。则滤液A中溶质的物质的量浓度为________________________。
13.钛被誉为“太空金属”、“未来钢铁”,原因是它的强度大,密度小,抗腐性能好。
(1)室温下,它不与水、稀盐酸、稀H2SO4、稀HNO3作用,但易溶于氢氟酸,推测其原因是 :
A.氢氟酸的酸性比其它酸强 B. 钛离子易与氟离子形成可溶性难电离物质
C.氢氟酸的还原性比其它酸强 D. 氢氟酸的氧化性比其它酸强
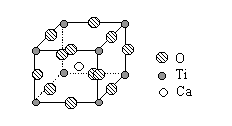
(2)钛的一种超导化合物——钙钛矿晶体中最小重复单元(晶胞)的结构如右图。请回答:
①该化合物的化学式为 ;
②在该化合物晶体中,与每个钛原子距离最近且相等的其它钛原子共有 个。
(3)由钛铁矿(其主要成分中各原子个数比与(2)中的化合物一样)提取钛的工艺流程表示如下(部分反应条件略去):
![]()
① 方框中所缺物质的化学式为 ;
② 上述5个反应中属于氧化还原反应的是 (填序号);写出其中一个的化学反应方程式: ;
③ TiCl4常温下为无色液体(熔点- 23.2℃,沸点136.4℃),在潮湿的空气中很容易形成烟雾,写出相应的
化学反应方程式: ;
TiCl4是_______化合物(填写:“离子”或“共价”)。
14.(1)在某天然产物中得到一种有机物分子X,分子式为C10H14,经酸性高锰酸钾氧化后得到有机物A和B,A经高碘酸氧化后得到分子式为C2H4O2的酸和CO2。而B是二元羧酸,可由环戊二烯和乙烯经双烯加成的产物用酸性高锰酸钾氧化得到。请给出化合物A、B和X的结构简式(可用键线式表示)。
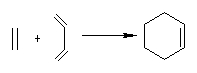 提示:①
②
提示:①
②
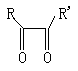 |
+HIO4+H2O→RCOOH+R’COOH+HIO3
A B X
(2)A、B、C、D四种烃,摩尔质量之比是1:2:3:4,且它们的实验式都是C7H5,都只有3 种一硝基取代物。
写出A、B、C、D的结构简式(各写一例);
、 、 、
15.Cu、Cu2O和CuO组成的混合物,加入100mL0.6mol∙L-1HNO3溶液恰好使混合物溶解,同时收集到224mLNO气体(标准状况)。求:
⑴写出Cu2O跟稀硝酸反应的化学反应方程式___________________________。
⑵产物中硝酸铜的物质的量___________mol。
⑶如混合物中含0.01moLCu,则其中Cu2O、CuO的物质的量分别是________mol、
__________mol。
⑷如混合物中Cu的物质的量为X,求其中Cu2O、CuO的物质的量及X的取值范围________________、________________、______________。
高考化学冲刺训练(1)
1、C 2、A 3、C 4、B 5、C 6、AD 7、C 8、D 9、AD 10、BD
11.(11分)
(1)参见教材
(2)B.是安全装置,可调节体系压强; D.是冷却装置
(3)C.吸收乙烯中混有的SO2、CO2; D.吸收逸出的溴蒸气,防止污染空气
(4)乙醇脱水制乙烯,乙烯与溴加成(方程式略)
12.(1)![]() ,
,![]() (2分/个,共4分)
(2分/个,共4分)
(2)① 3Fe2+ + NO3-+ 4H+ == 3Fe3+ + NO↑+ 2H2O(3分)
② ![]() (3分)
(3分)
(3)0.2 mol/L(2分)
13.(1)B
(2)①CaTiO3 ② 6
(3)①:H2TiO3
②:④⑤;
④:![]() 或⑤:
或⑤:![]()
③:TiCl4+3H2O = H2TiO3+4HCl ; 共价
14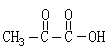
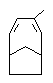
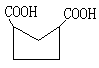
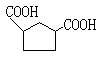 .(1)
.(1)
, 或
 (2)
(2)
15.(8分)
(1)3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O(2分)
(2)0.025mol(2分)
(3)0.005mol 0.005mol(4分)
(4)(0.015-x)mol (1分) (x-0.005)mol(1分) 0.005<X<0.015(2分)