十堰市第一中学2006届高三第二次联考
化学试题
命题人 张久龙
考试时间2005年10月19日下午3:00-4:40
试题说明:本试题考查的主要内容为第三册教材中的四、五、六单元和高一教材的前三章。
可能用到的相对原子质量:
H:1 O:16 C:12 N:14 S:32
Cl:35.5 Na:23 K:39 Fe:56 Al:27
第I卷 选择题(共48分)
一、选择题:(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1、接触法制硫酸的接触室里有一个热交换器,关于它的作用比较确切的说法是( )
A、给催化剂加热;
B、把反应时生成的热,传递给需要预热的混合气体,并冷却反应后生成的气体;
C、为了提高反应温度,让热的水蒸气通过热交接器;
D、为了充分利用热,让冷水通过热交接器。
2、下列仪器使用前不需要检查是否漏水的是( )
A、长颈漏斗 B、分液漏斗 C、滴定管 D、容量瓶
3、2004年,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质,已知硫化羰与二氧化碳的结构相似,但能在氧气中完全燃烧,下列有关硫化羰的说法正确的是( )
A.1 mol硫化羰在氧气中完全燃烧时转移6mol电子; B.硫化羰可用作灭火剂
C.CO2和COS结构相似都是非极性分子; D.硫化羰熔点可能较高
4、 在水溶液中,YO3n-和S2-发生如下反应:YO3n- + 3S2- + 6H+ = Y- + 3S↓+ 3H2O,则YO3n-中Y元素的化合价和原子最外层电子数分别为( )
A.+4、6 B.+7、7 C.+5、7 D.+5、5
5、用NA表示阿佛加德罗常数,下列说法错误的是( )
A.28g乙烯或丙烯完全燃烧均生成2NA CO2
B.1molCl2通入足量的NaOH溶液中充分反应转移的电子数为2NA
C.在标准状况下22.4L NH3含有原子数为4NA
D.2g H2所含原子数为2NA;
6、下列各组物质中仅用水就可以鉴别的是( )
①固体:NaCl、NaOH、NH4NO3;②气体:H2、O2、SO2;③液体:苯、酒精、四氯化碳;④固体:Ba(NO3)2、KCl、Na2SO4;⑤固体:AlCl3、Na2CO3、FeCl3。
A、③④⑤ B、只有③⑤; C、只有②③⑤; D、只有①③⑤
7、在热的稀硫酸溶液中溶解了11.4g FeSO4,当加入25mL 1.0mol/L KNO3溶液后,溶液中Fe2+ 恰好全部转化成Fe3+,KNO3也反应完全,并有氮氧化物气体逸出。则逸出的氮氧化物是( )
A、N2O B、N2O3 C、 NO D、NO2
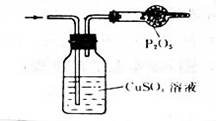
8、下列气体组(括号内的物质为杂质),可用下图装置进行提纯的是( )
A、H2S(HCl) B. NH3(CO2) C. C2H6(C2H4) D、CO(H2S)
9、在一密闭容器中有CO、H2、O2共16.5g,用电火花不断引燃,使其完全燃烧,再将燃烧后的气体用Na2O2充分吸收,Na2O2增重7.5g,则原混合气体中O2的质量分数是( )
A、33.3% B、36% C、40% D、54.5%
10、中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是( )
A、 用NaOH和HCl 反应测得的中和热,推算一定量稀H2SO4和NaOH 溶液反应的反应热
B、 用沸点数据推测两种液体混合物用蒸馏方法分离开来的可能性
C、 用沸点数据来分析分子的稳定性
D、用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性强弱
11、在化学学科中经常使用下列物理量,其中跟阿佛加德罗常数无关的组合是( )
①相对原子质量 ② 摩尔质量 ③ 原子半径 ④ 键能 ⑤ 物质的量
⑥ 化学反应速率 ⑦ 气体摩尔体积 ⑧ 溶解度 ⑨ 燃烧热 ⑩ 溶质的质量分数
A.①③⑧⑩ B.②④⑤⑥⑦⑨
C.②③④⑤ D.⑥⑦⑧⑨⑩
12、下列反应的离子方程式正确的是( )
A、少量二氧化硫气体通入到漂白粉溶液中;Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
B、碳酸钠的水解:CO32—+2H2O![]() H2CO3+2OH—
H2CO3+2OH—
C、少量的钠投入足量的水中:Na+2H2O=Na++2OH-+H2↑
D、向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7 Ba2++2OH-+2H++SO42—=BaSO4↓+2H2O
13、在由水电离出的c(H+)=1×10-13mol/L的溶液中能大量共存的离子组是( )
A、Mg2+、NO3—、MnO4—、Cl—; B、NO3—、Fe3+、Na+、K+;
C、Fe2+、NO3—、Ba2+、Cl—; D、HCO3—、Na+、Cl—、K+。
14、V mL Al2(SO4)3溶液中含有Al3+a g,取![]() V mL溶液稀释到4V mL,则稀释后溶液中SO42-的物质的量浓度是( )
V mL溶液稀释到4V mL,则稀释后溶液中SO42-的物质的量浓度是( )
A.![]() mol/L B.
mol/L B.![]() mol/L C.
mol/L C.![]() mol/L
D.
mol/L
D.![]() mol/L
mol/L
15、根据下表下列叙述中正确的是:( )
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
A.表中第①组反应的氧化产物一定只有FeCl3(实为Fe3+)
B.氧化性比较: KMnO4>Cl2>Fe3+>Br2>Fe2+
C.还原性比较: H2O2>Mn2+>Cl-
D.④的离子方程式配平后,H+的化学计量数为16
16、含11.2 g KOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物11.1 g,则该无水物中一定含有的物质是( )
A、 K2S和KHS B、KHS C. K2S D. KOH和KHS
第II卷(非选择题 共62分)
二、(本题包括2小题,共21分)
17、(共10分)
(1)(2分)在进行化学实验方案设计时,要遵循的基本要求有 。
①科学性;②安全性;③可行性;④简约性;⑤长期性。
(2)(4分)中学化学实验中通常有三类加热方式:酒精灯直接加热,垫石棉网加热和水浴方式加热。以下5个中学基本实验:①银氨溶液中滴入乙醛进行银镜反应;②实验室用蒸馏烧瓶蒸馏石油得到汽油和煤油;③用氯酸钾和二氧化锰制取氧气;④电石跟水反应制取乙炔;⑤蒸发食盐溶液得到氯化钠晶体。
a、酒精灯直接加热的有 ;
b、酒精灯垫石棉网加热的有 ;
c、水浴方式加热的有 。
(3)(4分)实验室中保存药品,易吸水、易潮解、易被氧化的物质要密封保存,见光易分解的物质需保存在棕色试剂瓶中,部分物质需要油封,如金属钠、钾可保存 中,金属锂保存在石蜡油中,部分物质需要水封,如白磷和 。
现有5种试剂:①浓硫酸;②硝酸银;③CaC2;④AgBr;⑤苯酚,按保存方法不同可分为两组,分别为 、 。(填序号)
18、(本题分为3个小题,共11分)
(1)(4分)配平下列氧化还原反应方程式(系数若为1也必须写出),回答有关问题.
□KClO3 + □HCl —— □Cl2↑ + □H2O + □KCl
HCl的作用是 ,被还原的元素是 .
(2)(3分)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol H2O(l)时放出571.6kJ的热量,H2的燃烧热为 ,表示H2燃烧热的热化学方程式为 。
(3)(4分)用石墨作电极电解CuSO4溶液,写出电极反应式为:阳极 ;
阴极 ;电解的总的化学方程式为 。
三、推断题(共9分)
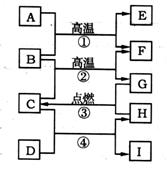 19、(9分)下列物质相互转化关系如下图所示:其中A、B、C、D、F为中学化学常见的氧化物,而B、E、G、H为常见的单质。其中D为淡黄色固体,E可作半导体材料,化合物I能跟A起反应,且I的水溶液PH>7。回答下列有关问题:
19、(9分)下列物质相互转化关系如下图所示:其中A、B、C、D、F为中学化学常见的氧化物,而B、E、G、H为常见的单质。其中D为淡黄色固体,E可作半导体材料,化合物I能跟A起反应,且I的水溶液PH>7。回答下列有关问题:
(1)D物质的名称是 ,E属于 晶体,组成H的元素在周期表第 周期 族,化合物I的电子式为 。
(2)写出有关的化学反应方程式:
① ;
② ;
③ ;
④ ;
四、实验题(共22分)
20、(12分) 有6瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜、碳酸钠。现只提供蒸馏水,通过下面的实验步骤即可鉴别它们。请填写下列空白:
(1)(2分)各取适量固体试剂分别加入6支试管中,加入适量蒸馏水,振荡试管,观察到的现象是: 。
被检出的物质的化学式(分子式)是 。
(2)(6分)分别取未检出的溶液少量,往其中加入上述已检出的溶液,观察到的现象和相应的离子方程式是:
被检出的物质的化学式(分子式)是 。
(3)(4分)鉴别余下未检出物质的方法和观察到的现象是:
。
21、(10分)实验室有一包 KCl和 AlCl3的固体混合物,通过以下实验可确定 KCl和 AlCl3的质量之比,试根据实验方法和主要步骤,回答有关问题:
(1)调整托盘天平的零点时,若指针偏向左边,应将左边的螺丝向 旋动。
 (2)某学生用已知质量为 a g的表面皿准确称取 W g样品,他在托盘天平的右盘上放上(W+a)g的砝码,在左盘的表面皿中放入样品,此时指针稍偏右边,该学生应怎样操作
__________________________________________________________________________________;
(2)某学生用已知质量为 a g的表面皿准确称取 W g样品,他在托盘天平的右盘上放上(W+a)g的砝码,在左盘的表面皿中放入样品,此时指针稍偏右边,该学生应怎样操作
__________________________________________________________________________________;
(3)将样品置于烧杯中加适量水溶解,滴入过量的A溶液,烧杯中有沉淀物,则A溶液是 ;
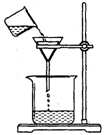
(4)过滤,某学生欲用右图装置操作,有两处错误应怎样纠正?
答: ;
(5)甲学生用水多次洗涤过滤所得沉淀物,然后使其干燥,得到固体纯净物C,质量为W2g,C物质的化学式是 ;
(6)乙学生将过滤所得滤液跟甲学生洗涤沉淀所得液体混合,然后蒸干溶剂,再充分加热,最后得到纯净KCl固体W1g,则原混合物中KCl与AlCl3的质量之比的计算式为 。
五、计算题:(共10分)
22.(10分)在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热使之充分反应,下图表示加入固体的质量与产生气体的体积(标准状况)的关系。试计算:
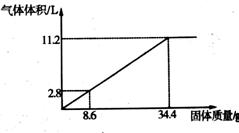 (1)NaOH溶液的物质的量浓度是多少?
(1)NaOH溶液的物质的量浓度是多少?
(2)当NaOH溶液为140mL,固体为51.6g时,充分反应产生的气体体积在标准状况为多少?
(3)当NaOH溶液为180mL,固体为51.6g时,充分反应产生的气体体积在标准状况为多少?
 翰林汇十堰市第一中学2006届高三第二次联考化学试题
翰林汇十堰市第一中学2006届高三第二次联考化学试题
参考答案
选择题答题栏(每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | B | A | A | C | B | D | C | D | D | C | A | D | B | C | D | C |
非选择题答题栏(共62分)
| 17、(共10分) (1)(2分) ①②③④ 。 (2)(4分)a ③⑤ 、b ② 、c ① 。 (3)(4分) 煤油或液体石蜡 、 液溴 、 ②④ 、 ①③⑤ 。 18.(共11分) (1)(4分)1KClO3 + 6HCl === 3Cl2 ↑+ 3H2O + 1KCl HCl的作用是 酸性和还原性 ,被还原的元素是 KClO3中的Cl元素 . (2)(3分) 285.8kJ/mol 、 H2(g)+1/2O2(g)=H2O(l);△H=-285.8kJ/mol 。 (3)(4分)阳极 4OH—-4e—=2H2O+O2↑ ;阴极 2Cu2++4e—=2Cu ; 总的化学方程式 19.(共9分,每空各1分)
(2)① 2C+SiO2 ③ 2H2+O2 20.(共12分) (1) 6种固体全部溶解,5支试管中得到无色溶液,1支试管中得到蓝色溶液; CuSO4 (2分) (2) 1支试管中有白色沉淀生成 Ba2++SO42-===BaSO4↓(2分); 2支试管中有蓝色沉淀生成 Cu2++2OH-=Cu(OH)2↓(2分)Cu2++CO32-=CuCO3↓(1分) 、BaCl2(1分) (3 ) (ⅰ) 分别取(2)中能产生蓝色沉淀的两种溶液少量,向其中加入BaCl2溶液,有白色沉淀生成的是Na2CO3溶液,无沉淀生成的是NaOH溶液。(2分) (ⅱ) 分别取少量未检出的溶液,往其中加入NaOH溶液,无明显现象的是Na2SO4溶液,有刺激性气味气体产生的是(NH4)2SO4溶液(2分) |
| 21.(共10分) (1)右;(1分) (2)往左盘表面皿上慢慢加少量样品,使指针指向标尺中间;(2分) (3)氨水;(1分) (4)漏斗下端管口应紧靠烧杯内壁,倾倒液体时应用玻璃棒引流;(2分) (5)Al(OH)3;(1分) (6)W1:(W-W1)或W1:133.5W2/78(3分) 22.(共10分) (1)(3分)5mol/L;(2)(4分)15.68L;(3)(4分)16.8L。 |