速率平衡图象题
解答此类图象题的方法与思路是:
(1)看懂图象:一看面(即看清横坐标和纵坐标),二看线(即看线的走向、变化的趋势),三看点(即看线是否通过原点,两条线的交点及线的拐点),四看要不要作辅助线(如等温线、等压线),五看定量图象中有关量的多少。
(2)联想规律:即联想外界条件对化学反应速率和化学平衡的影响规律,且熟练准确。
一.速率~时间图
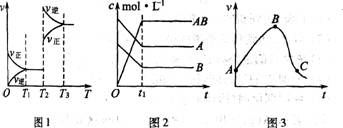
此类图象定性揭示了V正、V逆随时间(含条件改变对速率的影响)而变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。如N2+3H2
![]() 2NH3;△H<0建立平衡后加热对速率的影响如图1。
2NH3;△H<0建立平衡后加热对速率的影响如图1。
例题1.可逆反应aX(g)+b
Y(g) ![]() cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如图。则下列说法中正确的是( )
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如图。则下列说法中正确的是( )
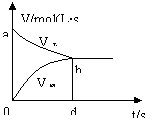
 A.若a+b=c,则t0时只能是增大了容器的压强
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容器的压强
D、若a+b≠c,则t0时只能是加入了催化剂
练习1.在容积固定的2L密闭容器中,充入X、Y各2mol,发生可逆反应X(g)+2Y(g)
![]() 2Z(g),并达到平衡,以Y的浓度改变表示的反应速率v正、v逆与时间t的关系如图。则Y的平衡浓度表达式正确的是(式中S指对应区域的面积)…………( )
2Z(g),并达到平衡,以Y的浓度改变表示的反应速率v正、v逆与时间t的关系如图。则Y的平衡浓度表达式正确的是(式中S指对应区域的面积)…………( )
A.2-S aob B、1-Saob C.2-Sabdo D.1-Sbod
二.浓度~时间图
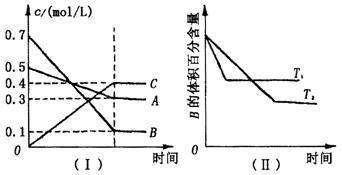
此类图象能说明各平衡体系组分(或某一成分)在反应过程中的变化情况。如A+B![]() 2AB反应情况如图2,此类图象要注意各物质曲线的折点(达平衡)时刻相同,各物质浓度变化的内在联系及比例符合化学方程式中的系数关系。
2AB反应情况如图2,此类图象要注意各物质曲线的折点(达平衡)时刻相同,各物质浓度变化的内在联系及比例符合化学方程式中的系数关系。
 例2.(2001全国高考)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是( )
例2.(2001全国高考)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是( )
A.反应的化学方程式为:2 M![]() N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D、t1时,N的浓度是M浓度的2倍
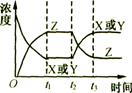
![]() 练习2.今有反应X(g)+Y(g) 2Z(g)(正反应为放热反应),若反应开始经t1s后达到平衡,又经t2 s后,由于反应条件的改变使平衡破坏,到t3
s时又达到平衡,如图所示,试分析从t2到t3的曲线变化的原因是
练习2.今有反应X(g)+Y(g) 2Z(g)(正反应为放热反应),若反应开始经t1s后达到平衡,又经t2 s后,由于反应条件的改变使平衡破坏,到t3
s时又达到平衡,如图所示,试分析从t2到t3的曲线变化的原因是
A增大了X和Y的浓度 B.使用了催化剂
C.增加了反应体积的压强 D、升高了反应的温度
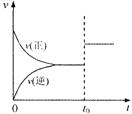
三.全程速率一时间图
如Zn与足量盐酸的反应,反应速率随时间的变化如图3。解释原因:AB段(v渐增),因反应为放热反应,随反应的进行,温度渐增,导致反应速率的渐增;BC段(v渐小),则主要因为随反应的进行。溶液中c(H+)渐小,导致反应速率的减小。
四.含量~时间~温度(压强)图
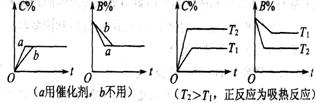 常见形式有如下几种,如图。(C%指产物百分数;B%指某反应物百分数)(在其他条件不变时,改变任一条件,如使用催化剂或温度升高或压强增大,都能缩短到达平衡的时间)
常见形式有如下几种,如图。(C%指产物百分数;B%指某反应物百分数)(在其他条件不变时,改变任一条件,如使用催化剂或温度升高或压强增大,都能缩短到达平衡的时间)
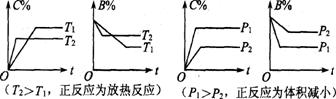
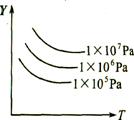
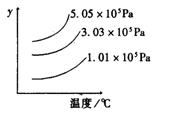
五.恒压(温)线
该类图的纵坐标为物质的平衡浓度(c)或反应物的转化率(α),横标为温度(T)或压强(P),常见类型如右图。
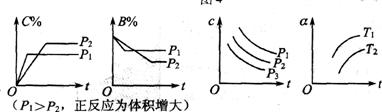
![]() 例3.对于反应m
A(s)+nB(g) eC(g)+fD(g),反应过程中,当其他条件不变时,C在混合气体中的体积分数与T(温度)或p(压强)关系如图所示,下面几种叙述中正确的是(
)
例3.对于反应m
A(s)+nB(g) eC(g)+fD(g),反应过程中,当其他条件不变时,C在混合气体中的体积分数与T(温度)或p(压强)关系如图所示,下面几种叙述中正确的是(
)
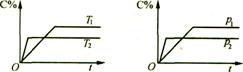 A.使用催化剂,平衡时C在混合气体中的体积分数增大
A.使用催化剂,平衡时C在混合气体中的体积分数增大
B.升温,化学平衡向正反应方向移动
C、化学方程式的化学计量数关系n<e+f
 D.其他条件不变,增加体系的压强,平衡正向移动
D.其他条件不变,增加体系的压强,平衡正向移动
练习3.T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示;若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图(Ⅱ)所示.则下列结论正确的是( )
A.在(t1+10)min时,保持其它条件不变,增大压强,平衡向逆反应方向移动
B.其它条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
C、T℃时,若由0.4mol/L A、0.4mol/L B和0.2mol/L C反应,达到平衡后,C的浓度仍为0.4mol/L
D. (t1+10)min时,保持压强不变,通入稀有气体,平衡向正反应方向移动
六、其他
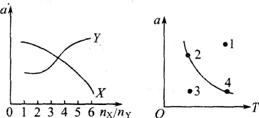 如图(右1)在一定条件下,将X、Y按不同的物质的量比放入密闭容器中反应,平衡后测得X和Y的转化率(α)与起始两物质的量之比[n(x)/n(y)]的关系如图,据此可推知X、Y,的反应式系数比为3:1.
如图(右1)在一定条件下,将X、Y按不同的物质的量比放入密闭容器中反应,平衡后测得X和Y的转化率(α)与起始两物质的量之比[n(x)/n(y)]的关系如图,据此可推知X、Y,的反应式系数比为3:1.
![]() 如图(右2)曲线是其他条件不变时,其反应物的最大转化率(α)与温度(T)的关系曲线,图中标出的1、2、3、4四个点,表示v正>
v逆点是3,表示v正<v逆的点是1,而2,4点表示v正= v逆。
如图(右2)曲线是其他条件不变时,其反应物的最大转化率(α)与温度(T)的关系曲线,图中标出的1、2、3、4四个点,表示v正>
v逆点是3,表示v正<v逆的点是1,而2,4点表示v正= v逆。
例4.在容积固定的密闭容器中存在如下反应: A(g)+3B(g) ![]() 2C(g); △H<0
2C(g); △H<0
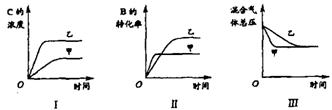 某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断一定错误的是
A、图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B、图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
练习4.已知某可逆反应mA(g)+nB(g) ![]() pC(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与
pC(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与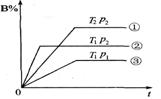 反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是 ( )
反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是 ( )
A. Tl<T2 p1>p2,m+n>p △H<0
B. Tl>T2 p1<p2,m+n>p △H>0
C. Tl<T2 p1>p2,m+n<p △H<0 D、 Tl>T2 p1<p2,m+n<p △H>0
巩固练习
1.在一定条件下,反应A(g)+B(g) ![]() C(g);△H<0达到平衡后,根据下列图象判断;
C(g);△H<0达到平衡后,根据下列图象判断;

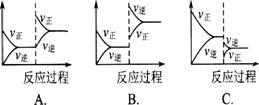
(1)升温,达到新的平衡的是( ) (2)降压.达到新的平衡的是( )
(3)减少c的量,移向新平衡的是( ) (4)增加A的量,移向新平衡的是( )
(5)使用催化剂,达到平衡的是( )
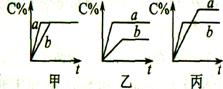 2.现有可逆反应A(g)+B(g
2.现有可逆反应A(g)+B(g![]() 3C(g),右图中甲、乙、丙分别表示在不同的条件下,生成物c在反应混和物中的百分含量(C%)和反应时间的关系:
3C(g),右图中甲、乙、丙分别表示在不同的条件下,生成物c在反应混和物中的百分含量(C%)和反应时间的关系:
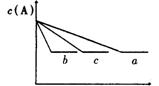
(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则 曲线是表示有催化剂时的情况。
(2)若乙图中的a曲线表示200℃和b曲线表示100℃时的情况.则此可逆反应的正反应是 热反应(填“放热”或“吸热”),其△H 0(填“大于”、“小于”或“等于”)。
(3)若丙图中两条曲线分别表示不同压强下的情况,则 曲线是表示压强较大的情况。
 3.左图表示外界条件(温度、压强)的变化对下列反应的影响:
3.左图表示外界条件(温度、压强)的变化对下列反应的影响:
L(s)+G(g) ![]() 2R(g);△H>0,则图中Y轴是指( )
2R(g);△H>0,则图中Y轴是指( )
A.平衡混合气中R的质量分数
B、平衡混合气中G的质量分数
C.G的转化率
D.L的转化率
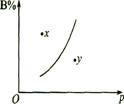 4.mA(s)+nB(g)
4.mA(s)+nB(g) ![]() pC(g);△H>0的可逆反应中,在恒温条件下,B的体积分数B%与压强(p)关系如图所示。有关叙述正确的是 ( )
pC(g);△H>0的可逆反应中,在恒温条件下,B的体积分数B%与压强(p)关系如图所示。有关叙述正确的是 ( )
A.m+n<p
B.n>p
C、x点,v正> v逆,y点,v正< v逆
D、x点比y点反应速率漫
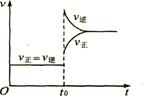 5.往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)
5.往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) ![]() 2HI(g);△H<0,当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是 ( )
2HI(g);△H<0,当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是 ( )
A、容器内气体颜色变深,平均分子量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度变小
D、改变条件前后,速度图象为(如右图)
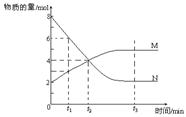
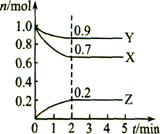 6.某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
6.某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为 ;
(2)反应开始至2min,气体Z的平均反应速率为 ;
(3)若X、Y、Z均为气体,反应达平衡时:
①此时体系的压强是开始时的 倍;
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为 反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时 (填增大、减小或相等);
(4)此反应达平衡后,若只加大体系压强,Z的物质的量减少,若Y是气体,则X的聚集状态是 。
7.相等物质的量的X气体和Y气体混合后,一定条件下发生反应:X(g)+Y(g)![]() nZ(g)。保持压强不变,经时间t,Z气体在反应混合物中的体积分数与温度(T)的关系如图Ⅰ所示。
nZ(g)。保持压强不变,经时间t,Z气体在反应混合物中的体积分数与温度(T)的关系如图Ⅰ所示。
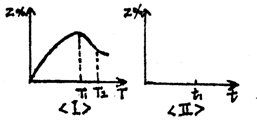 (1) 此反应的正反应方向是(填吸热或放热)
反应。
(1) 此反应的正反应方向是(填吸热或放热)
反应。
(2) T1表示此反应在时间t内达化学平衡时的(填最高或最低) 温度。若保持T1不变(此时间为t1),请在图Ⅱ上描绘出Z%与时间t的关系曲线。
(3) 在T<T1的某一温度时,该反应能否建立平衡(填能或不能) 。
(4) 若在T2时增大压强,达新平衡时Z%将增大,则化学方程式中n的取值为 。
8.在容积相同的不同容器中,分别充入同量的N2和H2,在不同的温度
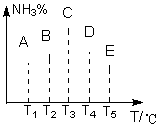 体积,发生反应N2 +H2
体积,发生反应N2 +H2![]() 2NH3,并在第7秒时分别测定其中NH3的体积分数并绘成如图曲线。
2NH3,并在第7秒时分别测定其中NH3的体积分数并绘成如图曲线。
(1).A、B、C、D、E五点中,尚未达到化学平衡的点是:
(2).可逆反应的正反应是 (填“吸”或“放”)热反应;
(3).AC段,曲线是增函数曲线,CE曲线是减函数曲线。试从化学反应速率和化学平衡角度说明理由
。
(4).由T1向T2变化时,v正 v逆(填>、<、=)。由由T3向T4变化时,v正 v逆(填>、<、=)。
9. 在密闭容器里通A、B两种气体,发生如下可逆反应A(气)+2B(气) ![]() 2C(气)+2D(气)+Q(Q<0),下列示意图正确的是( )
2C(气)+2D(气)+Q(Q<0),下列示意图正确的是( )
![]()


 V A% c% 300℃ 浓度
V A% c% 300℃ 浓度
![]()
![]()
![]()

![]()
 V正 V逆
500℃ 100℃
D
V正 V逆
500℃ 100℃
D
![]()
![]()
![]()
![]() 1×107Pa
1×107Pa
![]()
![]() 1×106Pa A
1×106Pa A
![]() 温度 时间 压强 时间
温度 时间 压强 时间
A B C D
10. 用来表示可逆反应2A(气)+B(气)![]() 2C(气)+Q的正确图象是
2C(气)+Q的正确图象是
![]()
![]()
![]()


 c% 100℃ V V正
V V逆
V 500℃
c% 100℃ V V正
V V逆
V 500℃
 | |||||
![]()
![]() 500℃ V逆 V正 100℃
500℃ V逆 V正 100℃
时间 温度 P P
A B C D
 化学平衡图形题:
化学平衡图形题:
1 右图表示外界(温度、压强)的变化对下列反应的影响L(s)+3G(g)===2R(g)(正反应为热反应),在图中,y轴是指
A平衡混合物中R的百分含量 B 平衡混合物中G的百分含量
C G的转化率 D L的物质的量
 2 反应A(g)+B(g)===C(g)在密闭容器中进行。若存在三种情况:①200℃,无催化剂;②500℃无催化剂;③500℃有催化剂;情况①是曲线 ,情况②是曲线 ,情况③是曲线 ,
2 反应A(g)+B(g)===C(g)在密闭容器中进行。若存在三种情况:①200℃,无催化剂;②500℃无催化剂;③500℃有催化剂;情况①是曲线 ,情况②是曲线 ,情况③是曲线 ,
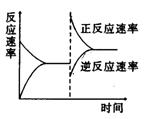 3 右图是关于反应A2(g)+3B2(g)===2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是
3 右图是关于反应A2(g)+3B2(g)===2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是
A 升高温度,同时加压。 B降低温度,同时减压 C 增大反应物浓度,同时使用催化剂; D 增大反应物浓度,同时减小生成物浓度
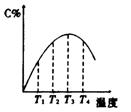 4 可逆反应A(g)+B(g)===2C(g)在不同的温度下经过一时间,混合物中C的体积分数与温度的关系如图所示,那么:⑴反应在 温度下达到平衡。⑵此反应的正反应为 热反应;⑶由T1向T2变化时正反应速率 逆反应速率(填>、<、=);⑷由T3向T4变化时正反应速率 逆反应速率(填>、<、=);
4 可逆反应A(g)+B(g)===2C(g)在不同的温度下经过一时间,混合物中C的体积分数与温度的关系如图所示,那么:⑴反应在 温度下达到平衡。⑵此反应的正反应为 热反应;⑶由T1向T2变化时正反应速率 逆反应速率(填>、<、=);⑷由T3向T4变化时正反应速率 逆反应速率(填>、<、=);
5 有一化学平衡mA(g)+nB(g)===PC(g)+qD(g),右图表示的转化率与压强、温度的关系。由此得出的正确结论是
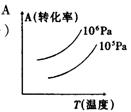 A 正反应是吸热反应,(m+n)>(p+q) B正反应是吸热反应,(m+n)<(p+q)
A 正反应是吸热反应,(m+n)>(p+q) B正反应是吸热反应,(m+n)<(p+q)
C正反应是放热反应,(m+n)>(p+q) D正反应是放热反应,(m+n)<(p+q)
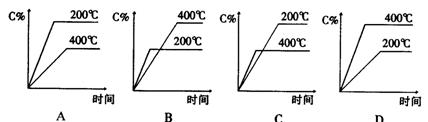
6 对可逆反应A(g)+B(g)===C(g)(正反应为吸热反应),下列图像正确的是
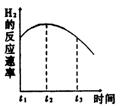
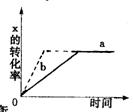
7 把镁条投入到有稀盐酸的试管,发现氢气产生的速率变化右图所示。其中t1→t2速率变化的主要原因是 ;t3 →t4速率变化的主要原因是
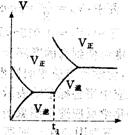 8 根据下列图象,推测相应改变的条件是( )
8 根据下列图象,推测相应改变的条件是( )
A 增大反应物浓度 B 增大生成物浓度 C 升高温度 D 加催化剂
 9 下列图象在t1时所对应的反应条件改变可能为:
9 下列图象在t1时所对应的反应条件改变可能为:
⑴升高温度 ⑵使用催化剂 ⑶增大反应物浓度 ⑷减少生成 物浓度
10 进行如下实验:在A锥形瓶中放入10g绿粒大的碳酸钙,在B锥形瓶中放入5g粉末状的碳酸钙,分别加入50ml 1mol/L盐酸。如下图(图中:X表示时间,Y表示锥形瓶中碳酸钙减少的质量)能正确表示实验结果的是( )
11
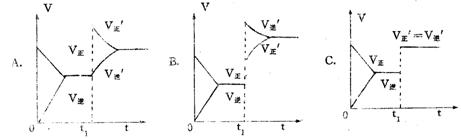 下列图象在t1时所对应的反应条件改变可能为:
下列图象在t1时所对应的反应条件改变可能为:
⑴升高温度或增大压强 ⑵加催化剂 ⑶ 增大反应物浓度
12对于2A(g)+B(g)===2C(g)(正反应为放热反应),符合该反应的下列图象:
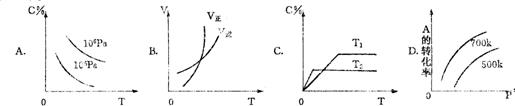
 13 下图中a曲线表示一定条件下可逆反应X(g)+Y(g)====2Z(g)+W(S)(正反应为放热反应)的反应过程。若使a曲线变为b曲线,可采用的措施是
13 下图中a曲线表示一定条件下可逆反应X(g)+Y(g)====2Z(g)+W(S)(正反应为放热反应)的反应过程。若使a曲线变为b曲线,可采用的措施是
A 加入催化剂 B 增大Y的浓度 C 降低温度 D 增大体系压强
14 下图表示平衡混合物中X的体积分数在不同的压强下随温度变化的情况,在下述的平衡体系中,X可以代表横线标明的物质(反应中各物质均为气态)是( )
A N2+3H2===2NH3正反应为放热反应 B H2+I2===2HI正反应为放热反应
C 2SO3====2SO2+O2正反应为吸热反应 D 4NH3+5O2====4NO+6H2O正反应为吸热反应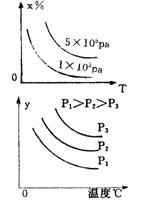
15 可逆反应L(S)+G(g)===2R(g)由右图分析Y所表示的量反应的能量变化为( )
A R的体积分数,正反应为放热反应 B G的体积分数,正反应为吸热反应
 C G的转化率,正反应为放热反应 D R的分解率,正反应为放热反应
C G的转化率,正反应为放热反应 D R的分解率,正反应为放热反应
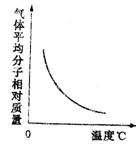
16 可逆反应2A+B===2C(g)正反应为放热反应,随温度变化气体平衡相对分子质量如图所示。则下列叙述正确的是
A A和B可能都是固体 B A和B一定都是固体 C 若B为固体则A一定为气体
D A和B可能都是气体
 17 在密闭容器中进行下列反应:M(g)+N(g)==R(g)+2L。此反应符合下列图象,R%为R在平衡混合物中的体积分数,该反应是( )
17 在密闭容器中进行下列反应:M(g)+N(g)==R(g)+2L。此反应符合下列图象,R%为R在平衡混合物中的体积分数,该反应是( )
A正反应为吸热反应 L是气体 B正反应为放热反应 L是气体
C正反应为吸热反应 L是固体 D正反应为放热反应 L是固体或液体
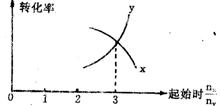 18 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应,达到平衡后,测得X,Y的转化率与起始时两物质的物质的量之比nx:ny的关系如图所示,则X和Y的反应方程式可表示为( )
18 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应,达到平衡后,测得X,Y的转化率与起始时两物质的物质的量之比nx:ny的关系如图所示,则X和Y的反应方程式可表示为( )
A 3X+Y===Z B 2X+Y===Z C X+3Y===Z D 3X+Y ===2Z
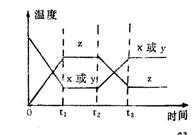 19今有X(g)+Y(g)====2Z(g)正反应为放热反应,从反应开始经过t1S后达到平衡状态t2S时,由于条件改变,平衡受到破坏,在t3S时又到平衡。根据右图回答:从t2S到t3S间的曲线变化是由哪种条件引起的
19今有X(g)+Y(g)====2Z(g)正反应为放热反应,从反应开始经过t1S后达到平衡状态t2S时,由于条件改变,平衡受到破坏,在t3S时又到平衡。根据右图回答:从t2S到t3S间的曲线变化是由哪种条件引起的
A 增大X或Y的浓度 B 增在压强 C 增大Z的浓度 D 升高温度
 20下图表示反应:N2+3H2===2NH3建立平衡的过程,如果用纵坐标表示物质的量浓度,横坐标表示时间来绘制这一反应的图形,则下列图形中一举正确的是
20下图表示反应:N2+3H2===2NH3建立平衡的过程,如果用纵坐标表示物质的量浓度,横坐标表示时间来绘制这一反应的图形,则下列图形中一举正确的是
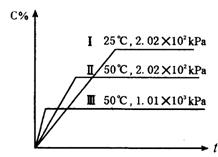 21在一密闭容器中进行如下反应:A(g)+B(g)====2C(g)+2D,此反应符合右图(其中C%是混合物中C的质量分数,t为反应时间)对此反应的叙述正确的是
21在一密闭容器中进行如下反应:A(g)+B(g)====2C(g)+2D,此反应符合右图(其中C%是混合物中C的质量分数,t为反应时间)对此反应的叙述正确的是
A 正反应为吸热反应,D是固体; B 正反应为吸热反应,D是气体;
C 正反应为放热反应,D是固体或液体;, D 正反应为放热反应,D是气体;
答案:1 A、C; 2 a、c、b; 3 D;4 T3 、、放、>、< ;5 A; 6 D ;7 该反应是放热的使溶液的温度升高,故反应速率加块;C(H+)不断减少,减少了反应物浓度,反应速率减少;8 A;9 C、D、A、B
10 C、;11 B、C、A; 12 A、C; 13 A;14 A; 15 A、C;16 B、C; 17 C; 18 A、D;19 D; 20 A、C;21 D;