武汉市部分重点中学十月理科综合月考试卷(化学)
一、选择题:(本题包括8小题,每小题6分,共48分,每小题只有一个正确答案)
6.一定量的铁粉和9克硫粉混合加热,待其反应后再加入过量盐酸,将生成的气体完全燃烧,共收集得9克水,求加入的铁粉质量为
A.14g B.42g C.56g D.28g
7.浓度不等的两种硫酸溶液等质量混合后,溶液的质量分数为a%,而等体积混合后,溶液的质量分数为b%;浓度不等的两种氨水等质量混合后,其质量分数为a%,而等体积混合后,溶液的质量分数为c%,那么a、b、c数值的关系是
A. a>b>c B. b>a>c C. c>b>a D. c>a>b
8.六氟化硫分子呈正八面体,难以水解,在高电压下仍有良好的绝缘性,在电器工业有着广泛用途,但逸散到空气中会引起强温室效应。下列有关SF6的推测正确的是
A.SF6易燃烧生成二氧化硫 B.SF6中各原子均达到 8 电子稳定结构
C.高温条件下,SF6微弱水解生成H2SO4和HF D.SF6是极性分子
9.设阿伏加德罗常数为NA,则下列说法正确的是
A.常温常压下,11.2L甲烷中含有的氢原子数小于2NA
B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C.常温下,2.7g铝与足量的盐酸反应,失去电子数为0.2NA
D.常温下,1L0.1mol/LMgCl2溶液中含Mg2+数为0.2NA
10.下列离子方程式中不正确的是
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
B.用Pt电极电解MgCl2溶液:Mg+2Cl-+2H2O![]() Mg(OH)↓+H2↑+Cl2↑
Mg(OH)↓+H2↑+Cl2↑
C.碳酸氢钠溶液与硫酸氢钠溶液反应:HCO3-+H+=CO2↑+H2O
D.将少量的硝酸银溶液滴入氨水中:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
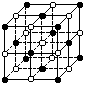 11.KO2的晶体结构与NaCl相似,可以看作是Na+的位置用K+代替,
11.KO2的晶体结构与NaCl相似,可以看作是Na+的位置用K+代替,
Cl-的位置用O2-代替,下列对KO2晶体结构的描述正确的是
A.和K+距离相同且最近的O2-共有8个
B.和K+距离相同且最近的K+共有6个
C.和K+距离相同且最近的O2-构成的多面体是正八面体
D.和K+距离相同且最近的O2-构成的多面体是正六面体
12.已知某溶液中存在较多的H+、SO42—、NO3—,则该溶液中还可能大量存在的离子组是
A.Al3+、CH3COO—、Cl— B.Mg2+、Ba2+、Br—
C.Mg2+、Cl—、I— D.Na+、NH4+、Cl—
13. 已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ
A.热量。表示上述反应的热化学方程式正确的是:
C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(g) △H=-48.40kJ·mol-1
B.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) △H=-5518kJ·mol-1
C.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) △H=+5518kJ·mol-1
D.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) △H=-48.40kJ·mol-1
二、实验题:(每空3分,共27分)
26. S2Cl2是一种金黄色易挥发的液体(熔点:-76℃,沸点:138℃),具有强烈的窒息性,且易与水发生水解反应,生成H2S、SO2、H2SO3、H2SO4等物质。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。
在熔融的硫中通以氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。
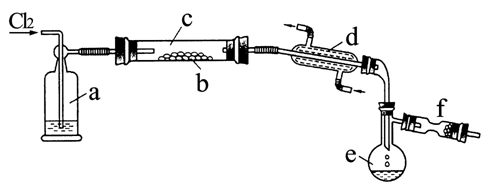
(1) 已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式: 。
(2) 装置a中应放试剂为: 浓HSO ,其作用为: 干燥 Cl ;装置c为何水平放置: 防止熔融的硫堵塞导管 ;装置d的名称是: 冷凝管 ,它的作用是:使生成的S冷凝成液体 。
(3) 该实验的操作顺序应为: ②③①⑤④(或③②①⑤④) (用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(4) 图中f装置中应放置的试剂为: 碱石灰 ,其作用为: 吸收Cl尾气,防止空气中的水汽使SCl水解 。
三、填空题:(共3小题,共汁36分)
27. (19分)A、B、C、D为4种常见的短周期元素,常温下A、B可形成两种液态化合物,其最简式分别为BA和B2A;B与D可形成分子X,也可形成阳离子Y,X、Y在水溶液中酸、碱性正好相反;C+的焰色反应呈黄色。
⑴C元素在周期表中的位置是: 第三周期, 第一主族 ;液态X类似B2A,也能微弱电离产生电子数相同的两种离子,则液态X的电离方程式为:2NHNH+ + N H2-。
⑵M、N是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且物质的量浓度相等的M、N溶液中水的电离程度前者小于后者。则M、N分别为(填化学式) NaOH 、 NHNO 3;若将0.1mol·L-1 M和0.2mol·L-1 N两种溶液等体积混合后所得溶液中离子浓度的大小顺序为: _ c(NO-) > c(NH+) > c(Na+) > c(OH-) > c(H+) 。
⑶氮可以形成多种离子,如N3-、N3-、NH2-、NH4+、N2H5+、N2H62+。N2H6+是由中性分子结合质子形成的,有类似于NH4+的性质。
① N3-离子半径比Na+离子半径__大____(填“大”、“小”),写出Na3N与水反应的化学方程式: NaN + 3HO = 3NaOH + NH↑ 。
② NH![]() 离子中N-H键的键角为 109°28’,离子化合物NH5的电子式为: 。
离子中N-H键的键角为 109°28’,离子化合物NH5的电子式为: 。
③ 写出N2H![]() 离子与过量强碱溶液反应的离子方程式:NH2+ + 2OH- = NH + 2HO 。
离子与过量强碱溶液反应的离子方程式:NH2+ + 2OH- = NH + 2HO 。
28.(9分)石灰氮(固体甲)是一种古老而多用途的有效肥料,它很容易用廉价的普通化学品乙来生产,乙高温加热分解产生白色固体A和无色气体B,后者不支持燃烧。用碳高温还原A生成灰色固体C和气体D,C和D能进一步氧化,且C必须密封保存,否则遇潮湿空气即产生含碳质量分数最高的常见气态烃,C与氮气反应,最终生成固体甲。经测定固体甲由三种元素组成,其中钙元素占50.00%、碳占15.00%(元素质量分数)
⑴完成下列合成固体甲的反应方程式:[由“石灰氮是化肥”可知固体甲中含钙、氮元素,含碳量最高的气态烃必是C2H2,可知C是CaC2,甲中含氮元素质量分数35.00%,故甲是CaCN2。(以上推理过程不作要求)]
① 乙![]() A+B:CaCaO+C
A+B:CaCaO+C
② A+碳→C+D:CaO+3C==CaC+CO↑
③ C+氮气→甲+单质:CaC+NCaCN+C
⑵写出固体甲水解的反应方程式:CaCN+3HOCaCO↓+2NH↑ 。
29. (8分)下图每一方框中的字母代表一种反应物或生成物,它们都是中学化学中常见的物质。产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,L是水,D是淡黄色固体。
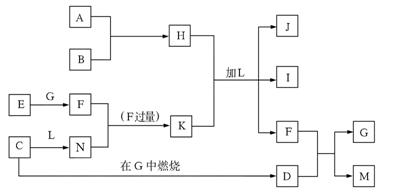 |
试填写下列空白:
⑴F的化学式为___ CO__ 。
⑵检验M中阴离子常用的试剂是盐酸和澄清石灰水 。
⑶反应C+G→D的化学方程式是___2Na+O_ 。
⑷写出反应H+L+K→J+I+F的离子方程式:Al3++3HCO-==Al(OH)↓+3CO↑ 。
化学答题卡
班级 座号 姓名 得分
一、选择题:(本题包括8小题,每小题6分,共48分,每小题只有一个正确答案)
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | D | B | C | A | A | C | D | B |
二、实验题:(每空3分,共27分)
 26.
26.
⑴S2Cl2的电子式: ![]() 。
。
⑵ 浓HSO4 , 干燥Cl2 ; 防止熔融的硫堵塞导管 ;
冷凝管 , 使生成的S2Cl2冷凝成液体 。
⑶ ②③①⑤④(或③②①⑤④) (用序号表示)。
⑷ 碱石灰 , 吸收Cl尾气,防止空气中的水汽使SCl水解 。
三、填空题:(共3小题,共汁36分)
27. ⑴C元素在周期表中的位置是: 第三周期, 第一主族 ;
X的电离方程式为:2NH 3![]() NH+
+ NH2- 。
NH+
+ NH2- 。
⑵M、N分别为(填化学式) NaOH 、 NHNO 3;
离子浓度的大小顺序为: c(NO3-) > c(NH 4+) > c(Na+) > c(OH-) > c(H+) 。
⑶ ① N3-离子半径比Na+离子半径__大____ (填“大”、“小”),
Na3N与水反应的化学方程式: Na3N + 3H2O = 3NaOH + NH3↑ 。
② NH![]() 离子中N-H键的键角为 109°28’,离子化合物NH5的电子式为: 。
离子中N-H键的键角为 109°28’,离子化合物NH5的电子式为: 。
③反应的离子方程式:N2H62+ + 2OH- = N2H4 + 2H2O 。
28.⑴完成下列合成固体甲的反应方程式:
① 乙![]() A+B:CaCO3
A+B:CaCO3![]() CaO+CO2↑
CaO+CO2↑
② A+碳→C+D:CaO+3C== CaC2+CO↑
③ C+氮气→甲+单质:CaC2+N2== CaCN2+C
⑵写出固体甲水解的反应方程式:CaCN2+3H2O== CaCO3↓+2NH3↑ 。
29. ⑴F的化学式为___ CO2__ 。
⑵检验M中阴离子常用的试剂是:盐酸和澄清石灰水 。
⑶反应C+G→D的化学方程式是:___2Na+O2== Na2O2__ 。
⑷写出反应H+L+K→J+I+F的离子方程式:Al3++3HCO3-== Al(OH↓+3CO2↑ 。