忻州实验中学2005学年高三月考(10月)
化 学
考生须知:
1.本卷满分100分,考试时间100分钟。
2.答题前,在答题卷密封区内填写班级和姓名、学号。
3.所有答案必须写在答题卷上,写在试卷上无效。
4.考试结束,只需上交答题卷。
考试时不能使用计算器。
本卷可能采用的相对原子质量:H-1,C-12,O-16, K-39,I-127
一、选择题(每小题只有一个选项符合题意,每小题2分,共16分)
1.溶液、胶体和浊液这三种分散系的根本区别是
A.是否为大量分子或离子的集合体 B.分散质微粒直径的大小
C.能否透过滤纸或半透膜 D.是否均一、稳定透明
2.我国科学家在世界上首次发现铂的一种新同位素![]() Pt,下列说法正确的是
Pt,下列说法正确的是
A.![]() Pt的相对原子质量为202 B.
Pt的相对原子质量为202 B.![]() Pt的原子质量为202
Pt的原子质量为202
C.铂元素的质量数为202 D.![]() Pt的原子核内有124个中子、
Pt的原子核内有124个中子、
3.下列物质属于分子晶体的化合物是
A.石英 B.硫磺 C.干冰 D.食盐
4.下列各组分子中,属于含极性键的非极性分子的是
A.H2S B.CCl4 C.Cl2 D.NH3
5.下列反应中,Na2O2既不是氧化剂又不是还原剂的是
A.2Na2O2+2H2O=4NaOH+O2↑ B.2Na2O2+2CO2=2Na2CO3+O2↑
C.2Na2O2+H2SO4=Na2SO4+H2O2 D.3Na2O2(熔融)+Fe2O3=2Na2FeO4+Na2O
6.水泥和冶金工业所产生的废气中含有大量的烟尘,其中大部分烟尘微粒直径在1~100 nm之间。工业上采用将废气通过连有高压电的铁丝的方法净化之。这种做法所应用的原理是
A.电泳 B.电解 C.凝聚 D.布朗运动
7.下列事实与氢键有关的是
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
8.下列各组离子能在溶液中大量共存,且溶液呈透明显碱性的是
A.AlO2—、CO32—、Na+、K+ B.Al3+、Cl-、AlO2—、Na+
C.Na+、OH-、H2PO4-、NO3— D.Fe2+、K+、H+、NO3—
二、选择题(每小题只有一个选项符合题意,每小题3分,共24分)
9.已知25℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g) = CO2(g) ; △H=-393.51 kJ·mol-1
C (金刚石) +O2 (g) = CO2(g) ; △H=-395.41 kJ·mol-1
据此判断,下列说法正确的是
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
10.下列叙述正确的是
A.同周期元素中,ⅦA族元素的原子半径最大
B.现已发现的零族元素的单质在常温常压下均为气体
C.ⅥA族元素的原子,其半径越大,越容易得到电子
D.所有的主族元素的简单离子的化合价与其族序数相等
11.燃烧1g乙炔(C2H2)生成二氧化碳和液态水,放出热量50kJ, 则这一反应的热化学反应方程式为
A.2C2H2(g)+ 5O2(g)=== 4CO2(g)+ 2H2O(l);△H= +50kJ/mol
B.C2H2(g)+ 5/2O2(g)===2CO2(g)+ H2O(l);△H= —1300kJ
C.2C2H2+ 5O2 ===4CO2 + 2H2O ;△H= —2600kJ
D.2C2H2(g)+ 5O2(g)===4CO2(g)+ 2H2O(l);△H= —2600kJ/mol
12.做电泳实验时, 氢氧化铁胶体颗粒向阴极移动, 原因是
A.Fe3+带正电荷
B.Fe(OH)3胶体颗粒吸附阳离子
C.Fe(OH)3胶体带负电, 吸附阳离子
D.通电后, 阴极附近产生大量OH-, 而 Fe(OH)3胶体颗粒带正电荷, 故向阴极移动
13.下列反应的离子方程不正确的是
A. 用氨水吸收过量的SO2:NH3·H2O+SO2=NH4++HSO3—
B. FeSO4溶液中加H2O2:2Fe2+ + H2O2+ 2H+ = 2Fe3+ +2H2O
C.Ca(ClO)2溶液中通过量的CO2:Ca2+ + 2ClO—+ H2O+CO2=CaCO3↓+2HClO
D.Fe(NO3)3溶液中加过量氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
14.已知a An +, b B( n + 1 )+, c Cn–, d D( n + 1 )–是具有相同的电子层结构的短周期元素形成的简单原子,下列叙述正确的是
A.原子半径:C > D > A > B B.原子序数:b > a > c > d
C.离子半径:C > D > A > B D.单质还原性:A > B > C > D
15.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是
A.3 Cl2 + 6 FeI2 = 2FeCl3 + 4 FeI3 B.Cl2 + FeI2 = FeCl2 + I2
C.Co2O3 + 6 HCl = 2CoCl2 + Cl2↑+ 3H2O D.2Fe3+ + 2I— = 2Fe2+ + I2
16.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.2∶9 B.1∶9 C.1∶5 D.1∶7
三、(本题包括3小题,共20分)
17.(6分)W、X、Y、Z四种短周期元素的原子序数为X>W>Z>Y,W原子的最外层电子数是X原子最外层电子数的一半,Y原子最外层电子数是次外层电子数的2倍,Z原子次外层电子数是最外层电子数的1/3,这四种元素原子核电荷数总和为37。
(1)这四种元素是X ▲ ,Y ▲ ,Z ▲ ,W ▲ (填元素符号)
(2)这四种元素原子半径的大小为 ▲ > ▲ > ▲ > ▲ (填元素符号)
(3)W、X元素的最高价氧化物对应的水化物的碱性强弱为 ▲ < ▲ (用化学式表示)
18.(6分)某主族元素R的单质可被稀硝酸氧化为R3+,R3+最外层有两个电子,在碱性条件下,R3+可被Cl2氧化成带一个单位负电荷的含氧酸根阴离子,该阴离子在酸性条件下能将Mn2+氧化成MnO![]() ,同时本身又被还原为R3+。试写出有关反应的离子方程式(不必确定R为何元素):
,同时本身又被还原为R3+。试写出有关反应的离子方程式(不必确定R为何元素):
(1)__ ▲_____;
(2) __ ▲_____;
(3) __ ▲_____。
19.(8分)某无色溶液中含有K+、Cl-、OH-、SO![]() 、SO
、SO![]() ,为检验溶液中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、品红溶液和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
,为检验溶液中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、品红溶液和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
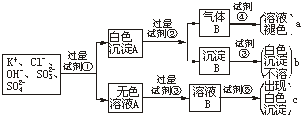
(1)图中试剂①~⑤溶质的化学式分别是:
①___▲___,②___▲___,③__▲____,④___▲___,⑤___▲__。
(2)图中现象a、b、c表明检验出的离子分别是:a__▲____、b__▲____、c___▲___。
四、(本题包括2小题,共14分)
20.(8分)根据实验室中测定硫酸铜晶体结晶水含量的实验,填写下列空白:
(1)从下列仪器中选出所需仪器(用标号字母填写)____ ▲_____。
A.托盘天平(带砝码) B.研钵 C.试管夹 D.酒精灯 E.蒸发皿 F.玻璃棒 G.坩埚 H.干燥器 I.石棉网 J.三脚架
除上述仪器外,还需要的仪器是__▲____。
(2)某学生实验后得到以下数据
| 加热前质量 | 加热后质量 | |
|
|
|
|
| 5.4g | 7.9g | 6.8g |
该学生测定结果是偏高还是偏低?____ ▲_____,从下列分析中进行选择,该学生实验误差的原因可能是(填写字母)___ ▲_____。
A.加热前称量时容器未完全干燥 B.最后两次加热后的质量相差较大(大于0.1g)
C.加热后容器未放入干燥器中冷却 D.加热过程中有少量晶体溅失
21.(6分)下列有关实验的叙述,正确的是(填序号) ▲
(A)配制500 mL某物质的量浓度的溶液,可用两只250 mL的容量瓶
(B)用渗析法分离淀粉中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)用酸式滴定管量取20.00mL高锰酸钾溶液
(E)为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H)浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
(J)在氢氧化铁胶体中加入少量硫酸会产生沉淀
(K)用结晶法可以除去硝酸钾中混有的少量氯化钠
五、(本题包括2小题,共16分)
22.(10分)麻醉剂的发现和使用,是人类历史上了不起的一项成就,它可使患者在接受治疗时感觉不到疼痛。
(1)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为N2O与CO2具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为___▲___,其空间构型是__▲___型,由此可见它是___▲__分子(填“极性”或“非极性”)。
(2)另一种常用麻醉剂氯仿,常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2 →2HCl+2COCl2,为防止中毒事故,使用前可用于检验氯仿是否变质的试剂是 ▲ 。
A、酚酞试液 B、淀粉碘化钾溶液
C、NaOH溶液 D、硝酸银稀溶液
(3)作为麻醉剂,氙气在医学上备受重视,氙能溶于细胞质的油脂里,引起细胞的麻醉和膨胀,从而使神经末梢作用暂时停止,人们曾使用体积分数为80%的氙气和20%的氧气组成混合气体,作为无副作用的麻醉剂。
①氙在元素周期表中位于第 ▲ 周期, ▲ 族,它的原子序数为 ▲ 。
②稀有气体氙的化学性质不活泼,但它在一定条件下可与其他物质反应生成化合物。现取1 mol氙气和3.5 mol氟气放于密闭容器中,在一定条件下使反应完毕,剩余1.5 mol氟气,同时有1 mol白色固体生成,此白色固体的化学式为 ▲ 。
23.(6分)在氯酸钾的分解反应里,二氧化锰的催化问题到目前还没有肯定的解释。鉴于制得的氧气中有氯气的气味,生成的氯化钾又略显紫红色,认为反应过程如下:
Ⅰ:2KClO3+2MnO2==2A+B↑+C↑
Ⅱ:2A==D+MnO2+C↑
Ⅲ:B+D==2KCl+MnO2+O2↑
①反应Ⅰ 氧化产物为(填化学式) ▲ 。
②反应Ⅲ的化学方程式为 ▲ 。
③按照上述反应过程,若生成1.5molO2,总共有 ▲ mol电子发生转移。
六、(每题包括2小题,共10分)
 24.(4分)右图为某市售盐酸试剂瓶标签上的部分数据。
24.(4分)右图为某市售盐酸试剂瓶标签上的部分数据。
问:该盐酸的物质的量浓度为多少?(列式计算)
25.(6分)为了预防碘缺乏病,国家规定每千克食盐中应含有40~50毫克的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。 将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的Na2S2O3溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。
有关反应如下:IO3-+5I-+6 H+=3I2+3H2O;
I2+2S2O32-=2I-+S4O62-
 杭州第十中学2005学年高三月考(10月)
杭州第十中学2005学年高三月考(10月)
化学答卷 成绩
一、选择题(本题包括8个小题,每小题2分,共16分。每小题只有一个选项符合题意。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
| 得分 |
二、选择题(本题包括8个小题,每小题3分,共24分。每小题只有一个选项符合题意。)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
| 得分 |
| 得分 |
三、(本题包括3小题,共20分)
17.(6分)
(1)这四种元素是X ,Y ,Z ,W
(2)这四种元素原子半径的大小为 > > >
(3)W、X元素的最高价氧化物对应的水化物的碱性强弱为 <
18.(6分)
(1)
(2)
(3)
19.(8分)
(1) (1)图中试剂①~⑤溶质的化学式分别是:
①___ ___,②___ ___,③___ ___,④___ ___,⑤___ ___。
(2)图中现象a、b、c表明检验出的离子分别是:a__ ____、b__ ____、c___ ___。
| 得分 |
四、(本题包括2小题,共14分)
20.(8分)
(1) __ ___。
除上述仪器外,还需要的仪器是__ ____。
(2) ___ __,___ __。
21.(6分)
| 得分 |
五、(本题包括2小题,共16分)
22.(10分)
(1) 、 、
(2)
(3)① 、 、
②
23.(6分)
① 。
②反应Ⅲ的化学方程式为 。 。
| 得分 |
六、(每题包括2小题,共10分)
24.(4分)
25.(6分)
化学参考答案(10月)
一、选择题(本题包括8个小题,每小题2分,共16分。每小题只有一个选项符合题意。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | D | C | B | C | A | B | A |
二、选择题(本题包括8个小题,每小题3分,共24分。每小题只有一个选项符合题意。)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | A | B | D | B | C | B | A | D |
三、(本题包括3小题,共20分)
17.(6分)(1) Mg, C, O, Na (各1分,共4分)
(2)rNa>rMg>rC>rO (1分,全对给分) (3)Mg(OH)2<NaOH
18.(6分)
(1)R+4H++NO![]() ====R3++NO↑+2H2O(2分)
====R3++NO↑+2H2O(2分)
(2)R3++Cl2+6OH-====RO![]() +2Cl-+3H2O(2分)
+2Cl-+3H2O(2分)
(3)5RO![]() +2Mn2++14H+====5R3++2MnO
+2Mn2++14H+====5R3++2MnO![]() +7H2O(2分)
+7H2O(2分)
19.(8分)(1)Ba(NO3)2 (1分) HCl (1分) HNO3(1分) 品红溶液(1分) AgNO3(1分)
(2)SO![]() (1分) SO
(1分) SO![]() (1分) Cl-(1分)
(1分) Cl-(1分)
四、(本题包括2小题,共14分)
20.(8分)(各2分)
(1)A、B、D、F、G、H、J;坩埚钳、泥三角、药匙
(2)偏高; A、D
21.B C D G J K (每个1分,共6分)
五、(本题包括2小题,共16分)
22.(10分)(1) 、 直线 、 极性 (3分)
(2) D (2分)
(3)① 五 、 0 、 54 (3分)
② XeF4 (2分)
23.(6分)(各2分)
(1)KMnO4和O2 (2)Cl2+K2MnO4===2KCl+MnO2+O2↑(3)6
六、(每题包括2小题,共10分)
24. c(HCl)==1000×1.18×36.5%÷36.5==11.8 mol·L-1 (4分)
25.(6分)
解:I2+2S2O32-→2I-+S4O62-
![]() (1分)
(1分)
IO3-+5I-+6 H+→3I2+3H2O
![]() (2分)
(2分)
每千克食盐中含KIO3:
![]() (2分)
(2分)
∴该加碘食盐是合格的 (1分)