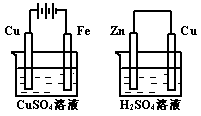湖南省石门一中高三第四次月考化学试卷
txjy
第Ⅰ卷(选择题,共60分)
txjy
一、选择题(本题包括20小题,每小题3分,共60。每小题只有一个选项符合题意。)
1.旨在限制发达国家温室气体排放量、抑制全球范围内气候持续变暖的《京都议定书》随着俄罗斯的加入,于2005年2月16日正式生效。我国二氧化碳的排放量位居世界第二,为减少二氧化碳这种温室气体的排放,下列措施不切实际的是
A.大力开发氢能源 B.充分利用太阳能
C.不使用含碳能源 D.提高能源利用率
txjy
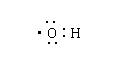
 2.下列化学用语表示错误的是
2.下列化学用语表示错误的是
A.次氯酸电子式 B.羟基电子式
![]() C.镁离子结构示意图
D.氨分子结构
C.镁离子结构示意图
D.氨分子结构
txjy
3.居室装修用石材的放射性常用![]() 作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
A.一个![]() 原子中含有138个中子 B.Ra元素位于元素周期表中第六周期ⅡA族
原子中含有138个中子 B.Ra元素位于元素周期表中第六周期ⅡA族
C.RaCl2的熔点比CaCl2高 D.Ra(OH)2是一种两性氢氧化物
txjy
4.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol·L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中一定正确的是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
5.硝酸铵(NH4NO3)在不同条件下分解可以得到不同的产物,下列各组物质中肯定不可能是硝酸铵分解产物的是
A.N2O、H2O B.N2、O2、H2O C.N2、HNO3、H2O D.NH3、NO、H2
6.设NA表示阿伏加德罗常数,下列说法中正确的是
A.1mol甲基正离子(CH3+)所含电子数为8NA
B.在反应CaO+3C高温CaC2+CO↑中,若生成1molCO,则转移电子数为3 NA
C.由2H和18O所组成的水11g,其中所含的中子数为5NA
D.SiO2晶体中,1mol硅原子形成2NA个Si-O共价键
7.下列离子方程式不正确的是
A.NaHS溶液中通入足量氯气:HS-+Cl2 ==S↓+H++2Cl-
B.用碳酸钠溶液吸收少量二氧化硫气体:2CO32-+SO2+H2O ==2HCO3-+SO32-
C.硫化钠溶于水中:S2-+2H2O ![]() H2S↑+2OH-
H2S↑+2OH-
D.将少量氯气通入溴化亚铁溶液中:2Fe2++Cl2==2Fe3++2Cl-
8.类推的思维方法在化学学习和研究中常会产生错误的结论,因此类推出的结论最终要经过实践的检验才能决定其正确与否。下列几种类推结论中不正确的是
A.Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
B.Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成2PbO·PbO2
C.不能用电解熔融AlCl3来制取金属铝;也不用电解熔融MgCl2来制取金属镁
D.Fe与S直接化合生成FeS;Cu与S直接化合也可以得到Cu2S
9.用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家HenkVan Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg [c(H+)/c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是
A.Fe2+、K+、Cl- 、NO3- B.NH4+、Fe2+、 I一、SO42-
C.Na+ 、K+、ClO-、S2- D.Na+、S2O32-、AlO2— 、K+
|
|
|
A.在①中Cu棒为阳极;在②中Cu棒为负极
B.电极上析出物质的质量:①<②
C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑;
②中负极:2H++2e一=H2↑
D.溶液的pH:①不变;②增大
11.在一个体积可变的密闭容器中,盛有等物质的量的SO2、O2、SO3(g)的混合气体,在一定温度和压强下,反应达到平衡时,容器中混合气体的密度比反应前减少了1/13(温度、压强反应前后不变),则反应达到平衡时,混合气体中SO2占总体积的
A.1/3 B.1/6 C.2/13 D.6/13
12.在下列各说法中,正确的是
A.△H > 0 kJ·mol-1表示放热反应,△H < 0 kJ·mol-1表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1 mol H2SO4与1 molBa(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热
13.下列叙述正确的是
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.有单质参加或生成的反应一定属于氧化还原反应
C.失电子难的原子,获得电子的能力一定强
D.元素由化合态变成游离态时,它可能被氧化,也可能被还原
14.下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个离子方程式表示的是
A.稀盐酸 Na2CO3溶液 B.AlCl3溶液 NaAlO2溶液
C.Fe HNO3溶液 D.浓氨水 AgNO3溶液
15.有两种短周期元素X和Y,可以组成XY3,当Y的原子序数为M时,X的原子序数可能为①M—4 ②M+4 ③M+8 ④M-2 ⑤M+6,其中正确的是
A.①②④ B.①②③⑤ C.①②③④⑤ D.①②⑤
16.下列叙述正确的是
A.任何晶体中,若含有阳离子也一定含有阴离子
B.原子晶体中只含有共价键
C.离子晶体中只含有离子键
D.分子晶体中只存在分子间作用力,不含有其它化学键
17.已知常温常压和催化剂条件下,N2(g)和H2(g)生成2molNH3(g)放出92.4kJ的热量。在上述条件下向密闭容器中通入1molN2和3molH2,达到平衡时放出热量为Q1kJ;向另一体积相同的容器中通入0.9molN2、2.7molH2和0.2molNH3,相同条件下达到平衡时放出热量为Q2kJ.则下列关系式正确的是
A.2Q=Q1=92.4 B.Q2<Q1<92.4
C.Q1<Q2<92.4 D.Q1=Q2=92.4
18.下列实验数据记录正确的是
A.用天平称取4.0克NaOH固体,用100ml量筒配制1.0000mol/L的NaOH溶液
B.用25mL的滴定管(内装有标准NaOH溶液)滴定未知浓度的盐酸用去NaOH溶液 22.32mL
C.用pH试纸测得新制氯水的pH为4
D.常温下,用气球收集500mlNO2气体,求得NO2气体的物质的量为0.5/22.4mol
19.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌一锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+ H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说法正确的是
A.电池工作时,锌为正极
B.电池负极的电极反应式为:2MnO2(s)+ H2O(l)+2e-= Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由负极通过外电路流向正极
D.外电路中每通过0.1mol电子,锌的质量理论上减小6.5g
20.甲、乙两烧杯中分别盛放500mL等物质的量浓度的稀硫酸,向甲烧杯中加入mg铁粉,向乙烧杯加mg锌粒,完全反应后发现有一烧杯中仍有金属剩余,若H2SO4的物质的量浓度为xmol·L-1,则x的范围是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
第Ⅱ卷(非选择题,共50分)
21.(6分)下列三组试剂已失去标签,分别用一种试剂可以鉴别。
A、AlCl3、NaCl、Na2CO3三种溶液
B、Na2CO3、Na2SO4、K2S、Na2SO3、BaCl2、NaAlO2六种溶液;
C、CaC2、NaCl、CuSO4、CaCO3、Al2S3五种固体;
A组可选用 (填名称,下同);
B组可选用 ;
C组可选用 。
22.(10分)以石墨做电极电解200mL 0.5mol/L的CuSO4溶液,在标准状况下,阴极上收集到2.24L气体时,停止通电。请回答下列问题:
(1)电解过程中阴极的电极反应式为 、 ;(2分)
(2)电解过程中共收集到气体的体积为 ;
(3)若电解前后溶液的体积变化忽略不计,电解后溶液的pH值约为 ;
(4)电解结束后,欲使溶液恢复到电解前溶液的组成和浓度,可加入 mol ;(2分)
(5)电解时的电流强度为20安培,理论上所需电解时间为 分。(设1mol电子的电量为96500库仑)
23.(6分)已知某溶液中只含有4种离子:A+、B-、H+、OH-,对这4种离子浓度的大小比较,有以下3种说法。请判断离子浓度的大小顺序是否正确,你认为正确的请在相应的空格内填上符合这种情况的A+和B-组成物质的化学式(只写一种情况,可以是一种溶质或两种溶质);你认为一定不正确的,请在相应的空格内填上你选择“不正确”的理由。供选择的离子有:Na+、Ag+、NH4+、Cl-、NO3-、CH3COO-、H+、OH-
(1)c(B-)>c(A+)>c(H+)>c(OH-):
(2)c(A+)>c(B-)>c(OH-)>c(H+):
(3)c(H+)>c(B-)>c(A+) >c(OH-):
24.(8分)(2005年广东卷)下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
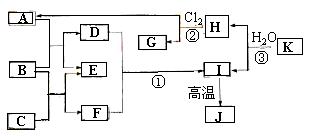
请按要求回答:
(1)写出B的化学式_______________,
G的电子式_________________。
(2)反应①的离子方程式为_______________________________________。
(3)反应③的化学方程式为________________________________________。
25.(12分)图(甲)是实验室用氢气还原氧化铜实验的微型快速实验装置.其中的粗铜丝“Ⅰ”可以在试管M中上下移动,实验前先将铜丝“Ⅰ”处理成下端弯曲的一小圆环,并用铁锤击成带小孔的小匙,虚线框中需连入图(乙)(仪器上下端位置固定)的某装置进行实验.图乙中的细铜丝“Ⅱ”一端被弯成螺旋状.
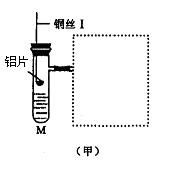
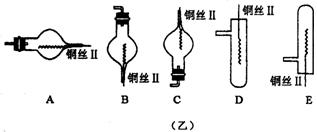
(1)在图甲中,试管M中的液体应选用_____________________________ __.
(2)在图示的虚线框中应连入的最合适的装置是________(填代号)
(3)上述制氢气的方法与将铝片直接加入试管中相比,其优点有_________ _______
______________________________________________________________________.
(4)实验过程中,在试管M中可观察到的现象是________________ _____________
_______________________________________________________________________
___________________________________________________________.
(5)实验时,细铜丝“Ⅱ”的操作方法是________________ ____________________
______________________________________________________________________
__________________________________________.
(6)若实验室无粗铜丝,而改用无锈粗铁丝,为让其反复使用,则此时M中的液体为
________;发生反应的离子方程式为__________________________________.
|
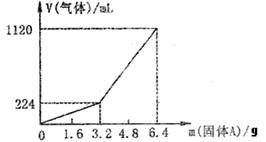
已知加入固体A的质量m≤3.2g时,收集到的气体为氢
气,当m>3.2g时收集到的气体为氢气和硫化氢的混合气。
试分析与计算:
(1)3.2g固体A中所含的物质有
(写化学式) 。
(2)3.2g固体A中各物质的物质的量分别为 。
溶于上述盐酸充分反应后,所得的溶液中氢硫酸的物质的量浓度为(忽略体积变化) 。
(3)当固体A全部溶于上述盐酸,且A的质量m>3.2g时,收集到的气体体积(标准状况下)V= mL。(用含m的代数式)
高三月考化学参考答案
1.D 2.C 3.A 4.C 5.D 6.A 7.C 8.C 9.B 10.D
11.D 12.B 13.D 14.B 15.C 16.B 17.B 18.B 19.C 20.B
21.A组:紫色石蕊试液或Ba(OH)2 B组:稀硫酸 C组:水
22.(1)Cu2++2e-=Cu, 2H++2e-=H2 (2)4.48L (3)0 (4)0.1mol Cu(OH)2 (5)32.2分
23.(1)NH4NO3或NH4Cl (2)CH3COONa (3)不正确,根据电荷守恒可知。(略)
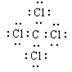 24.(1)Al
24.(1)Al
(2) Al3+ + 3AlO2— + 6H2O == 4Al(OH)3↓ (3) Al4C3 +12H2O == 4Al(OH)3 + 3CH4↑
25. (1)稀![]() (2)B
(2)B
(3)①易于控制![]() 的发生与停止;②形成Cu—Al原电池,加快反应速率
的发生与停止;②形成Cu—Al原电池,加快反应速率
(4)Al片溶解,有气泡产生
(5)先在酒精灯上灼烧到红热状态,然后再迅速插入干燥管中
(6)NaOH溶液; ![]()
![]()
26.(1)FeS, Fe. (2) n(Fe)=0.01mol n(FeS)=0.03mol. c(H2S)=0.1mol·L-1
(3)V=(280m-672)mL