湖南师大附中高三第三次月考
化学试卷
命题人:肖鹏飞 审题人:高三化学备课组
相对原子质量:H:1 C:12 O:16
第Ⅰ卷(选择题,共48分)
1、欲观察H2燃烧的焰色,燃气导管口的材料最好是
A、钠玻璃 B、钾玻璃 C、石英玻璃 D、铜管
2、下列各组物质的性质比较,不正确的是
A、熔点![]() B、溶解度
B、溶解度![]()
C、还原性![]() D、氧化性
D、氧化性![]()
3、欲除去小苏打溶液中混有的少量苏打,最好加入(或通入)
A、熟石灰 B、碳酸氢钙 C、盐酸 D、二氧化碳
4、下列金属冶炼的反应原理,错误的是
A、![]()
![]()
![]() B
B![]() 、MgO+H2
、MgO+H2![]() Mg+H20
Mg+H20
C、Fe304+4CO![]() 3Fe+4C02 D、2HgO
3Fe+4C02 D、2HgO![]() 2Hg+02 ↑
2Hg+02 ↑
5、用等量的小苏打制取C02,可用①煅烧法②与酸作用法,两种方法得到CO2的量
A、①大于② B、①小于②
C、相等 D、无法比较
6、下列除杂质的方法不可行的是
A、用过量氨水除去Al3+溶液中的少量Fe3+
B、将混合气体通过灼热的铜网除去N2中少量02
C、用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D 用盐酸除去AgCl中少量的Ag2C03
7、用1L 1.Omol/L NaOH溶液吸收0.8mol C02,所得溶液中含有
A、C032- B、HC03- C、C032-和HC03- D、C032-和OH-
8、1mol下述固体物质(1)Na20(2)Na0H(3)Na202(4)Na2S03,长期放置在空气中,其质量增加(不考虑潮解因素)正确的是
A、(1)=(2)>(3)>(4) B、(1)>(3)>(4)>(2)
C、(2)>(1)=(3)>(4) D、(4)>(2)>(3)>(1)
9、将0.2mol金属甲投入到1升0.1mol/L的盐酸中,反应完全后,再投入0.1mol金属乙,在整个过程中放出氢气最多的金属组是
| A | B | C | D | |
| 甲 | Mg | Na | K | Al |
| 乙 | Al | K | Al | Mg |
10、镁条在含有较多C02的空气中燃烧后,生成物有
A、MgO B、MgO、Mg3N2 C、MgO、Mg(OH)2 D、MgO、Mg3N2、C
11、常温下 ,能用铝制品盛装的药品是
A、浓硫酸 B、浓盐酸 C、稀硝酸 D、CuSO4溶液
12、某无色透明溶液能与铝反应放出H2,则该溶液中可大量共存的离子是
A、H+、Cl-、Ba2+、Cu2+ B、OH-、Ba2+、K+、Na+
C、H+、Na+、N03-、C1- D、OH-、Mg2+、NH4+、Cl-
13、下列反应的离子方程式正确的是
A、金属钠与饱和食盐水:Na+2H20=Na++20H-+H2↑
B、氧化钠与盐酸:Na20+2H+=2Na++H20
c、小苏打与苛性钠溶液:HC03-+OH-=C02↑+H20
D、碳酸氢钠与足量石灰水:2HCO3-+Ca2++20H-=CaCO3 +C032-+2H2O
14、下列除杂质试剂(括号中的物质)的选择,不正确的是
A、KHC03中混有K2C03(C02) B、NaOH中混有Na202(H20)
C、Na2C03中混有NaHC03(CaCl2)D、KN03中混有KHC03(HN03)
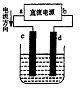 15、右图是电解Na2C03溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
15、右图是电解Na2C03溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
A、a为负极、b为正极 B、a为阳极、b为阴极
C、电解过程中,d电极的质量不变 D、电解过程中,C032-浓度不变
16、在含有1molKAl(S04)2的溶液中逐滴加入2molBa(OH)2溶液,下列有关说法中正确的是
A、先生成沉淀,后沉淀全部溶解
B、当溶液中A13+、SO42-全部沉淀出来时,沉淀的总物质的量最大
C、最后得到的沉淀是BaSO4
D、最后的沉淀为2molBaS04,lmolAl(OH)3
第Ⅱ卷(非选择题,共60分)
17、(8分)现有两瓶无色溶液,一瓶是AlCl3溶液,一瓶是NaOH溶液,不用任何试剂,鉴别它们的实验操作是 ,根据实验现象所做出的判断是
。 所发生的化学离子方程式为:
。
18、(10分)今有5瓶失去标签的溶液,只知道它们分别是:HCl、Na2C03、NaHC03、NaOH和Ca(HC03)2的水溶液,为了鉴别它们,分别以A、B、C、D、E为代号,用它们进行一些实验,记录如下:A与B混合时无明显现象;B与C混合时有沉淀生成;B与D混合后生成了E;A能使石蕊试液变红。由此推知:
A是 B是 C是 D是 E是 。
19、(22分)如图所示,各物质间存在如下相互转化关系,其中F为金属,能和氧化铁反应,生成铁单质。E和K为无色气体单质,其它物质均为化合物,A为无色气体,C为无色液体。试回答下列问题:
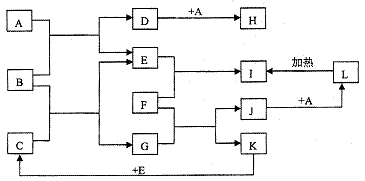 |
(1)写出F与氧化铁反应的化学反应方程式:
(2)写出E的名称:
(3)化合物B的电子式为:
(4)气体A的分子中存在 ,属于 分子,其固体属于 晶体。
(5)写出B与C反应的化学方程式:
(6)分别写出F与G反应的离子反应方程式及J生成L的离子反应方程式:
(7)分别写出H的固体转化为D、H的溶液转化为D的化学反应方程式:
,
20、(12分)某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H20晶体。(图中夹持及尾气处理装置均已略去)
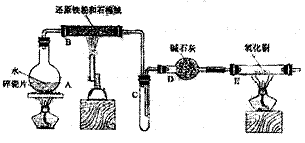 |
(1)装置B中发生反应的化学方程式是 。
(2)装置E中的现象是 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法: 。
(4)该小组学生利用上述滤液制取FeCl3.6H20晶体,设计流程如下:
滤液 FeCl3溶液 FeCl3.6H20晶体
①步骤I中通入C12的作用是 。
②步骤II从FeCl3稀溶液中得到FeCl3﹒6H20晶体的主要操作包括:
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明):
。
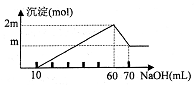
21、(8分)将一定量的铝和氧化镁样品溶于30mL 1mol/L稀硫酸中,样品完全溶解,向该溶液中逐滴加入氢氧化钠溶液,生成沉淀情况如图所示。试回答:
(1)当达到最大沉淀时,所用氢氧化钠溶液的体积为 ml,此时,溶液中的溶质为 。
(2) NaOH溶液的浓度为:
(3)原样品中铝和氧化镁的物质的量分别为多少?
(4)当生成的沉淀为1.5m时,所加NaOH溶液的体积为多少?
化学答题卡
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
第Ⅱ卷(非选择题,共60分)
17、(8分)实验操作是
根据实验现象所做出的判断是
离子方程式为: ,
18、(10分)A是 B是 C是 D是 E是 。
19、(22分)(1)F 与氧化铁反应的化学方程式:
(2)E的名称:
(3)化合物B的电子式为:
(4)A的分子中存在 ,属于 分子,其固体属于 晶体。
(5)B与C反应的化学方程式:
(6)F与G反应的离子反应方程式: ,
J生成L的离子反应方程式: 。
(7)H的固体转化为D的化学反应方程: ,
H的溶液转化为D的化学反应方程式 。
20、(12分)(1)装置B中发生反应的化学方程式 。
(2)装置E中的现象是 。
(3)检验滤液中Fe3+的操作方法:
(4)①步骤I中通入C12的作用是 。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H20晶体的主要操作包括:
③流程中保持盐酸过量,主要原因是(结合离子方程式简要说明):
21、(8分)(1)当达到最大沉淀时,所用氢氧化钠溶液的体积为 ml,
 此时,溶液中的溶质为
。
此时,溶液中的溶质为
。
(2)NaOH溶液的浓度为:
(3)原样品中铝物质的量为: ,
氧化镁的物质的量为为:
(4)当生成的沉淀为1.5m时,所加NaOH溶液的体积为多少?
第三次月考化学参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| C | B | D | B | B | A | C | B |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| C | D | A | B | B | C | C | C |
17.(8分)向B中逐滴加入A 若先生成沉淀,而后沉淀又溶解,则A为![]() 溶液
溶液![]()
![]()
18.(10分)![]()
![]()
![]()
![]()
![]()
19.(22分)(1)F与氧化铁反应的化学方程式:![]()
(2)氧气 (3)(4)极性键(或共价键) 非极性 分子
(5)![]()
(6)![]()
![]() 或
或
![]()
(7)![]()
![]()
20.(12分)(1)![]()
(2)黑色固体变红,右端管壁有水珠(3)取少量滤液,滴入几滴溶液,观察溶液是否变红色
(4)①将![]() 氧化成
氧化成![]() ②加热浓缩。冷却结晶,过滤
②加热浓缩。冷却结晶,过滤
③![]() ,过量盐酸抑制
,过量盐酸抑制![]() 水解
水解
21.(8分)(1)60![]()
![]() (2)
(2)![]()
(3)![]()
![]() (4)50
(4)50![]() 65
65![]()