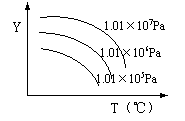化学平衡图像
一、 C——t(浓度——时间)图
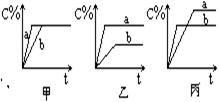
| 0.4 0.3 B 0.2 A 0.1 C 0 2 时间(分) |
 1、( )如图是800℃时,A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得到的结论是:
1、( )如图是800℃时,A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得到的结论是:
A、A是反应物
B、前2分钟,A的分解速率为0.1mol/L·min
C、若升高温度,A的转化率增大
D、增大压强,A的转化率减小
二、V——t(速度——时间)图
2、( )将2molSO2与1molO2加热到300℃,建立如下平衡:
![]() 2SO2(g)+O2(g) 2SO3(g)+Q
2SO2(g)+O2(g) 2SO3(g)+Q
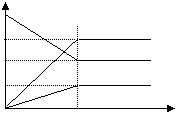
若其它不变,改变下列反应条件,引起正、逆反应速度V变化如下图所示,指出适宜以下情况的图像。
1、将密闭容器放置一个小时以达到平衡壮态( )2、平衡后其他条件不变加入V2O5( )
3、平衡后保持体积不变增大O2的浓度( )
4、平衡后保持体积不变将一部分SO3分离出( )
5、平衡后保持体积不变将一部分SO2分离出( )
6、将反应的温度由300℃升高到500℃( )7、将反应的温度由300℃降低到100℃( )
8、其他条件不变将反应容器扩大一倍 ( )9、其他条件不变将反应容器缩小1/2 ( )
10、保持容器体积不变,通入Ar气 ( )11、保持容器压强不变,通入Ar气 ( )
12、平衡后保持体积不变将反应混和物抽出一半( )
13、体积不变,再加2molSO2和1molO2 ( )14、压强不变,再加2molSO2和1molO2 ( )
15、压强不变,再加入2molSO3 ( ) 16、平衡后保持体积不变再加少量SO3 ( )
 |
三、 X%——T(X的体积百分数——温度)图或X的转化率——温度图
X%——P(X的体积百分数——压强)图或X的转化率——压强图
|
|
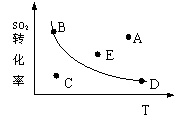
![]() 3、( )右图的曲线是在其它条件一定时反应
3、( )右图的曲线是在其它条件一定时反应
2SO2+O2 SO3+Q(Q>0) 中SO2的化率与温度的关系曲线,图上标有A、B、C、D、E五点,其中表示未达到平衡状态且V正>V逆的点是
A、A或E点 B、C点 C、B点 D、D点
4、( )在密闭容器中通入A、B两种气体,在一定条件下反应:
|
|
![]() 2A(g)+B(g) 2C(g)+Q(Q>0),达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线所示变化的是
2A(g)+B(g) 2C(g)+Q(Q>0),达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线所示变化的是
A、X——温度 Y——C的物质的量
B、X——压强 Y——混合气体的平均分子量
C、X——再加入A Y——C的物质的量
D、X——再加入A Y——A的转化率
关键:①找出X%(或转化率)随T、P的变化趋势;曲线上的点是平衡点,曲线外的是非平衡点。
四、X%(或转化率)——T——P (X的百分含量[转化率]——温度——压强)图
|
|
5、( )右图表示改变条件时,对反应
![]() A(g)+2B(g) 2C(g)+Q(Q>0)的影响情况,图中纵坐标y不能表示:
A(g)+2B(g) 2C(g)+Q(Q>0)的影响情况,图中纵坐标y不能表示:
A、平衡混合气体中C的百分含量
B、平衡混合气体中A的百分含量
C、A的转化率
D、C的生成率
关键:找出T(P)一定时,随P(T)变化Y%的变化趋势。
五、 X%(转化率)——T——t(X的百分含量[转化率]——温度——时间)图
X%(转化率)——P——t(X的百分含量[转化率]——压强——时间)图
|
|
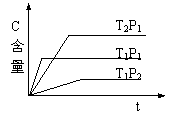
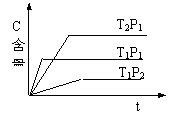
![]() 6、( )可逆反应:2A(g)+B(g) 2C(g),在温度分别为P1、P2条件下,测得C的含量与时间t的关系如图。下列说法正确的是:
6、( )可逆反应:2A(g)+B(g) 2C(g),在温度分别为P1、P2条件下,测得C的含量与时间t的关系如图。下列说法正确的是:
A、P2<P1 正反应是吸热反应
B、P2>P1 正反应是放热反应
C、P2>P1 逆反应是吸热反应
D、P2<P1 逆反应是吸热反应
关键:找出比较平衡点(时间、反应速度)及X的大小(平衡的移动)。
总结:图示题是中学化学各和类型考试的常见题型。它是将化学中的有关理论知识、元素化合物及计算内容与数学中的函数曲线相结合的一种题型
7、( )下列有关各项变化的图象其中正确的是:
A、在含Al3+的溶液中,加入NaOH溶液,生成沉淀质量W和加入的NaOH溶液V的关系
B、把Cl2通入SO2水溶液中,溶液的pH值和通入Cl2体积V的关系
![]() C、反应X2+3Y2 2XY3 进行时各成分的浓度C和时间t的关系
C、反应X2+3Y2 2XY3 进行时各成分的浓度C和时间t的关系
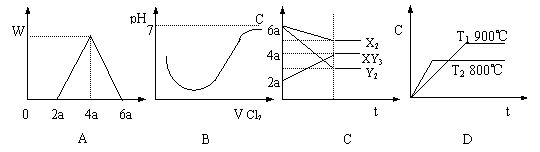 D、在密闭容器中高温加热石灰石时,容器中CO2浓度C和反应温度T及反应时间t的关系
D、在密闭容器中高温加热石灰石时,容器中CO2浓度C和反应温度T及反应时间t的关系
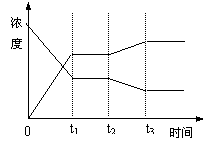
![]() 8、( )反应:X(g)+Y(g) 2Z(g)+Q,从反应开始经t1s时达平衡状态。在t2s末由于条件改变,平衡受到破坏,在t3s时达到新的平衡,右图表示上述反应过程中物质的浓度与反应时间的变化关系,图中t2——t3间的
8、( )反应:X(g)+Y(g) 2Z(g)+Q,从反应开始经t1s时达平衡状态。在t2s末由于条件改变,平衡受到破坏,在t3s时达到新的平衡,右图表示上述反应过程中物质的浓度与反应时间的变化关系,图中t2——t3间的
曲线变化是由那种条件的改变引起的![]()
A、增大X或Y的浓度
B、增大压强
C、增大Z的浓度
![]()
 D、降低温度
D、降低温度
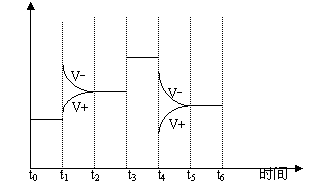
9、( )一密闭体系中发生下列反应:
![]() 2A(g)+3B(g) 2C(g)+热量
2A(g)+3B(g) 2C(g)+热量
左图是某一时间段中反应速度与反应进程
的曲线关系图。 回答下列问题:
⑴t1,t3,t 4 时刻体系中所改变的反应
条件分别是 , , 。
⑵C的体积百分含量最高的是: _____ 。
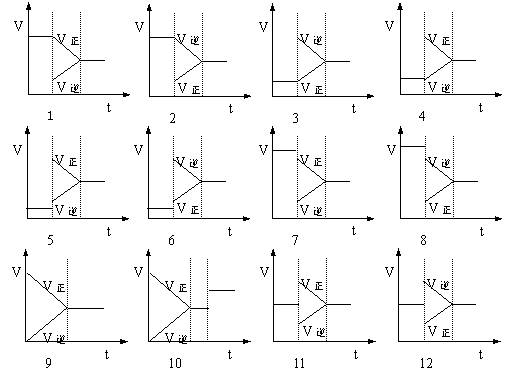
![]() 10、( )下列表示可逆反应:2A(气)+B(气) D(气)+Q(Q>0)的图示中正确的是
10、( )下列表示可逆反应:2A(气)+B(气) D(气)+Q(Q>0)的图示中正确的是
 A. B. C. D.
A. B. C. D.
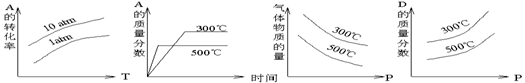
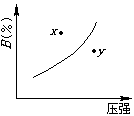
11、( )![]() 对于mA(固)+nB(气) pC(气)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是
对于mA(固)+nB(气) pC(气)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是
A.m+n<p B. x点的状态是v正>v逆
C. n>p D.x点比y点的反应速度慢
13、 ( )可逆反应mA(s)+nB(g)![]() pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中
pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中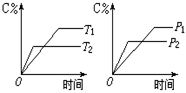 正确的是
正确的是
A.到达平衡后,若使用催化剂,C的质量分数增大
B.平衡后,若升高温度,平衡则向逆反应方向移动
C.平衡后,增大A的量,有利于平衡向正方向移动
![]()
 D.化学方程式中一定n>p+q
D.化学方程式中一定n>p+q
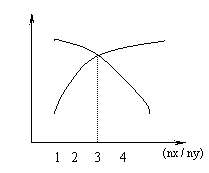
15、( )一定条件下,将X和Y两种物质按不同比例放入
密闭容器中,反应达平衡后,测得X、Y转化率与起
始时两种物质的量之比nx/ny 的关系如图,则X和Y
反应的方程式可表示为
![]() A.X +3Y 2Z B.3X+Y 2Z
A.X +3Y 2Z B.3X+Y 2Z
C.3X+2Y Z D.2X+3Y 2Z
16、( )在一定条件下,反应A(气)+B(气)![]() C(气)+Q达到平衡后,根据下列图象判断
C(气)+Q达到平衡后,根据下列图象判断
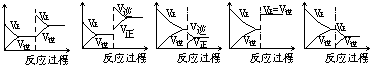
A. B. C. D. E.
(1)升温,达到新的平衡的是 ( ) (2)降压,达到新的平衡的是 ( )
(3)减少C的量,移向新平衡的是( ) (4)增加A的量,移向新平衡的是( )
(5)使用催化剂,达到平衡的是 ( )
18、现有可逆反应A(气)+B(气)![]() 3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
(1)若甲图中两条曲线分别表示有催化剂和
无催化剂时的情况,则_ __曲线是
表示有催化剂时的情况。
(2)若乙图中的a曲线表示200℃和b曲线
表示100℃时的情况,则此可逆反应的正反
应是_ __ __热反应。
(3)若丙图中两条曲线分别表示不同压强下的情况,则__ __曲线是表示压强较大的情况。
答 题 卡
| 1 | 2 | 3 | 4 | 5 | 6 |
| 7 | 8 | 9 | 10 | 11 | 11 |
| 13 | 14 | 15 | 16 | 17 | 18 |
化学平衡图像
一、 C——t(浓度——时间)图
| 0.4 0.3 B 0.2 A 0.1 C 0 2 时间(分) |
 1、( c )如图是800℃时,A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得到的结论是:
1、( c )如图是800℃时,A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得到的结论是:
A、A是反应物
B、前2分钟,A的分解速率为0.1mol/L·min
C、若升高温度,A的转化率增大
D、增大压强,A的转化率减小
二、V——t(速度——时间)图
2、( )将2molSO2与1molO2加热到300℃,建立如下平衡:
![]() 2SO2(g)+O2(g) 2SO3(g)+Q
2SO2(g)+O2(g) 2SO3(g)+Q
若其它不变,改变下列反应条件,引起正、逆反应速度V变化如下图所示,指出适宜以下情况的图像。
1、将密闭容器放置一个小时以达到平衡壮态( 9 )2、平衡后其他条件不变加入V2O5( 10 )
3、平衡后保持体积不变增大O2的浓度( 4 )
4、平衡后保持体积不变将一部分SO3分离出(1)
5、平衡后保持体积不变将一部分SO2分离出( 2 )
6、将反应的温度由300℃升高到500℃( 6 )7、将反应的温度由300℃降低到100℃( 7 )
8、其他条件不变将反应容器扩大一倍 ( 8 )9、其他条件不变将反应容器缩小1/2 ( 5 )
10、保持容器体积不变,通入Ar气 ( )11、保持容器压强不变,通入Ar气 ( 8 )
12、平衡后保持体积不变将反应混和物抽出一半( 8 )
13、体积不变,再加2molSO2和1molO2 ( 4 )14、压强不变,再加2molSO2和1molO2 ( 11 )
15、压强不变,再加入2molSO3 ( 12 ) 16、平衡后保持体积不变再加少量SO3 ( 3 )
 |
三、 X%——T(X的体积百分数——温度)图或X的转化率——温度图
X%——P(X的体积百分数——压强)图或X的转化率——压强图
|
|
![]() 3、( b )右图的曲线是在其它条件一定时反应
3、( b )右图的曲线是在其它条件一定时反应
2SO2+O2 SO3+Q(Q>0) 中SO2的化率与温度的关系曲线,图上标有A、B、C、D、E五点,其中表示未达到平衡状态且V正>V逆的点是
A、A或E点 B、C点 C、B点 D、D点
4、( bc )在密闭容器中通入A、B两种气体,在一定条件下反应:
|
|
![]() 2A(g)+B(g) 2C(g)+Q(Q>0),达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线所示变化的是
2A(g)+B(g) 2C(g)+Q(Q>0),达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线所示变化的是
A、X——温度 Y——C的物质的量
B、X——压强 Y——混合气体的平均分子量
C、X——再加入A Y——C的物质的量
D、X——再加入A Y——A的转化率
关键:①找出X%(或转化率)随T、P的变化趋势;曲线上的点是平衡点,曲线外的是非平衡点。
四、X%(或转化率)——T——P (X的百分含量[转化率]——温度——压强)图
|
|
5、( b )右图表示改变条件时,对反应
![]() A(g)+2B(g) 2C(g)+Q(Q>0)的影响情况,图中纵坐标y不能表示:
A(g)+2B(g) 2C(g)+Q(Q>0)的影响情况,图中纵坐标y不能表示:
A、平衡混合气体中C的百分含量
B、平衡混合气体中A的百分含量
C、A的转化率
D、C的生成率
关键:找出T(P)一定时,随P(T)变化Y%的变化趋势。
五、 X%(转化率)——T——t(X的百分含量[转化率]——温度——时间)图
X%(转化率)——P——t(X的百分含量[转化率]——压强——时间)图
|
|

![]() 6、( d )可逆反应:2A(g)+B(g) 2C(g),在温度分别为P1、P2条件下,测得C的含量与时间t的关系如图。下列说法正确的是:
6、( d )可逆反应:2A(g)+B(g) 2C(g),在温度分别为P1、P2条件下,测得C的含量与时间t的关系如图。下列说法正确的是:
A、P2<P1 正反应是吸热反应
B、P2>P1 正反应是放热反应
C、P2>P1 逆反应是吸热反应
D、P2<P1 逆反应是吸热反应
关键:找出比较平衡点(时间、反应速度)及X的大小(平衡的移动)。
总结:图示题是中学化学各和类型考试的常见题型。它是将化学中的有关理论知识、元素化合物及计算内容与数学中的函数曲线相结合的一种题型
7、( cd )下列有关各项变化的图象其中正确的是:
A、在含Al3+的溶液中,加入NaOH溶液,生成沉淀质量W和加入的NaOH溶液V的关系
B、把Cl2通入SO2水溶液中,溶液的pH值和通入Cl2体积V的关系
![]() C、反应X2+3Y2 2XY3 进行时各成分的浓度C和时间t的关系
C、反应X2+3Y2 2XY3 进行时各成分的浓度C和时间t的关系
 D、在密闭容器中高温加热石灰石时,容器中CO2浓度C和反应温度T及反应时间t的关系
D、在密闭容器中高温加热石灰石时,容器中CO2浓度C和反应温度T及反应时间t的关系
![]()
 8、( d )反应:X(g)+Y(g) 2Z(g)+Q,从反应开始经t1s时达平衡状态。在t2s末由于条件改变,平衡受到破坏,在t3s时达到新的平衡,右图表示上述反应过程中物质的浓度与反应时间的变化关系,图中t2——t3间的
8、( d )反应:X(g)+Y(g) 2Z(g)+Q,从反应开始经t1s时达平衡状态。在t2s末由于条件改变,平衡受到破坏,在t3s时达到新的平衡,右图表示上述反应过程中物质的浓度与反应时间的变化关系,图中t2——t3间的
曲线变化是由那种条件的改变引起的![]()
A、增大X或Y的浓度
B、增大压强
C、增大Z的浓度
![]()
 D、升高温度
D、升高温度
9、( )一密闭体系中发生下列反应:
![]() 2A(g)+3B(g) 2C(g)+热量
2A(g)+3B(g) 2C(g)+热量
左图是某一时间段中反应速度与反应进程
的曲线关系图。 回答下列问题:
⑴t1,t3,t 4 时刻体系中所改变的反应
条件分别是 , , 。
⑵C的体积百分含量最高的是: _____ 。
![]() 10、( bd )下列表示可逆反应:2A(气)+B(气) D(气)+Q(Q>0)的图示中正确的是
10、( bd )下列表示可逆反应:2A(气)+B(气) D(气)+Q(Q>0)的图示中正确的是

 A. B. C. D.
A. B. C. D.
11、( bd )![]() 对于mA(固)+nB(气) pC(气)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是
对于mA(固)+nB(气) pC(气)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是
A.m+n<p B. x点的状态是v正>v逆
C. n>p D.x点比y点的反应速度慢
13、 ( b )可逆反应mA(s)+nB(g)![]() pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中
pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中 正确的是
正确的是
A.到达平衡后,若使用催化剂,C的质量分数增大
B.平衡后,若升高温度,平衡则向逆反应方向移动
C.平衡后,增大A的量,有利于平衡向正方向移动
![]()
 D.化学方程式中一定n>p+q
D.化学方程式中一定n>p+q
15、( b )一定条件下,将X和Y两种物质按不同比例放入
密闭容器中,反应达平衡后,测得X、Y转化率与起
始时两种物质的量之比nx/ny 的关系如图,则X和Y
反应的方程式可表示为
![]() A.X +3Y 2Z B.3X+Y 2Z
A.X +3Y 2Z B.3X+Y 2Z
C.3X+2Y Z D.2X+3Y 2Z
16、( )在一定条件下,反应A(气)+B(气)![]() C(气)+Q达到平衡后,根据下列图象判断
C(气)+Q达到平衡后,根据下列图象判断
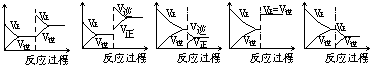
A. B. C. D. E.
(1)升温,达到新的平衡的是 ( b ) (2)降压,达到新的平衡的是 ( c )
(3)减少C的量,移向新平衡的是( e ) (4)增加A的量,移向新平衡的是( a )
(5)使用催化剂,达到平衡的是 ( d )
18、现有可逆反应A(气)+B(气)![]() 3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:

(1)若甲图中两条曲线分别表示有催化剂和
无催化剂时的情况,则_ 甲 __曲线是
表示有催化剂时的情况。
(2)若乙图中的a曲线表示200℃和b曲线
表示100℃时的情况,则此可逆反应的正反
应是_ __ 吸 __热反应。
(3)若丙图中两条曲线分别表示不同压强下的情况,则_b_曲线是表示压强较大的情况。
答 题 卡
| 1 | 2 | 3 | 4 | 5 | 6 |
| 7 | 8 | 9 | 10 | 11 | 11 |
| 13 | 14 | 15 | 16 | 17 | 18 |