黄冈市2005年秋季高三年级期末考试
化 学 试 题
黄冈市教育科学研究院命制
卷面总分llO分,考试时间90分钟。
可能用到的相对原子质量:H—1 C—12 O—16 N—14 Na—23 Cl—35.5
第Ⅰ卷 (选择题共48分)
本卷包括16小题。每小题3分,共48分。每小题后的4个选项中只有一个选项符合题目要求。
1.下列表达方式正确的是
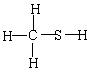
![]() A.碳—12原子
A.碳—12原子 ![]() B.羟基的电子式
B.羟基的电子式![]()
![]()
c.硫离子结构示意图 D.CH4S的结构式
2.下列实验或操作中:①溶解 ②过滤 ③蒸发 ④用pH试纸测定溶液的酸碱性 ⑤配制一定物质的量浓度的溶液。均要用到的仪器是
A.烧杯 B.玻璃棒 c.漏斗 D.胶头滴管
3.物质X(□)和物质Y(〇)的反应如下图所示,对该反应的描述,下列反应方程式正确的是
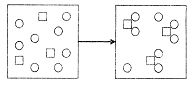 A.3X+8Y=X3Y8
A.3X+8Y=X3Y8
B.3X十8Y=3XY2十2Y
C.3X+6Y=X3Y6
D.X+2Y=XY2
4.常温下,在溶液中可以发生反应:![]() 对下列叙述的判断正确的是:①x被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥ Y3+的氧化性比X2+的氧化性强。
对下列叙述的判断正确的是:①x被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥ Y3+的氧化性比X2+的氧化性强。
A.②④⑥ B.①③④ C.①③⑤⑥ D.②⑤
5.在微粒中![]() ,电子数、质子数和中子数之比为
,电子数、质子数和中子数之比为
A. 10:7:11 B.11:11:8 C.10:l1:8 D.11:8:10
6.一种化学冰袋含有![]() ,用时将它们混台并用手搓揉就可制冷,且制冷效果能维持一段时间。以下关于其制冷原因的推测肯定错误的是:
,用时将它们混台并用手搓揉就可制冷,且制冷效果能维持一段时间。以下关于其制冷原因的推测肯定错误的是:
A.![]() 脱水是吸热过程
脱水是吸热过程
B.较长时间制冷是由于![]() 脱水较慢的过程
脱水较慢的过程
C.铵盐在该条件下发生的复分解反应是吸热反应
D.![]() 溶于水会吸收热量
溶于水会吸收热量
7.![]() 相同的氨水、
相同的氨水、![]() 溶液,分别用蒸馏水稀释到原体积的x倍、y倍和z倍。稀释后3种溶液的pH仍然相同,则x、y、z的关系是
溶液,分别用蒸馏水稀释到原体积的x倍、y倍和z倍。稀释后3种溶液的pH仍然相同,则x、y、z的关系是
A.![]() B.
B.![]()
![]() C.
C. ![]() D.
D.![]()
8.下列说法正确的是
A.等体积、等物质的量浓度的强酸中所含的H+数目一定相等
B.1L二氧化碳气体一定比lL氧气的质量大
C.同温同压下,相同体积的物质,它们的物质的量必定相等
D.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必定相等
![]() 9.下图是元索周期表中短周期的一部分,B原子与C原子核外原子数之和是A的4倍,则下 列推断正确的是
9.下图是元索周期表中短周期的一部分,B原子与C原子核外原子数之和是A的4倍,则下 列推断正确的是
A.A、b、C三者均为非金属元素
B.A、B、C三者可以共同形成一种离子化合物
C.A、B、C三者核电荷数之和为32
D.B的原子半径比C小
10.X、Y、Z为短周期元素,它们元素原子的最外层电子数分别为1、4、6,则由这三种元素组成的化合物的化学式不可能是
A.XYZ B.X2YZ C X2YZ2 D X2YZ3
11.在一定温度下,物质M的溶解度为Ag。向(100+A)g物质M的饱和溶液中加入A g M,析出带一定结晶水的晶体B g,现取出B g结晶水合物加水配成相同温度下的饱和溶液,需加水的质量为
A.100 g B.大于100 g C.小于100 g D.(100+A) g
12.在一定温度下,某浓度的硝酸与金属锌反应生成NO2和NO的物质的量之比为1:3,则要 使1 mol金属锌完全反应,需要硝酸的物质的量为
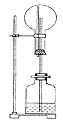 A.2.8 mol B.2.6 mol C.2.4
mol D.0.8mol
A.2.8 mol B.2.6 mol C.2.4
mol D.0.8mol
13.在如图所示的装置中,烧瓶中盛有空气,广口瓶中盛放下列物质时可发生喷泉的选项是
A.块状大理石和稀硫酸 B.NH4Cl与稀NaOH溶液
C.Na2O2与NaOH溶液 D.铜片与稀盐酸
14.下列离子方程式正确的是
A.水中加入过氧化钠固体:![]()
B.等物质的量的氢氧化钡溶液与明矾溶液混合
![]()
C.氢氧化镁与稀硫酸反应:![]()
D.单质铜与稀硝酸反应:![]()
 |
15.已知乙烯醇
16.已知某温度、压强下的气体摩尔体积为![]() ,在该条件下有
,在该条件下有![]() 气体X发生如下反应并达到平衡;
气体X发生如下反应并达到平衡;![]() ,测得混合气体中X的体积分数为58.80%,混合气体的总质量为
,测得混合气体中X的体积分数为58.80%,混合气体的总质量为![]() ,混合气体的的密度为
,混合气体的的密度为![]() 。则平衡混合气体的平均相对分子质量为
。则平衡混合气体的平均相对分子质量为
A.58.80 B.46.00 C.39.74 D.16.13
第Ⅰ卷答 题 栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
得分栏
| 题号 | 第Ⅰ卷 | 第Ⅱ卷 | 总分 | |||||
| 17 | 18 | 19 | 20 | 21 | 22 | |||
| 得分 | ||||||||
| 阅卷人 | ||||||||
第Ⅱ卷(非选择题 共62分)
本卷包括6道题,共62分。
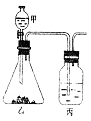 17.(7分)右图足化学实验中出现频率较高的装置,它是由物质制备和检验生成物性质两部分组成的(暂不考虑除杂、尾气的吸收),请你选用中学化学常见试剂设计一个实验,通过乙中的反应和丙中的实验现象,得出三种物质性质递变的结沦。将所用试剂名称、丙中现象及由此得出的实验结论填入下列空白处:
17.(7分)右图足化学实验中出现频率较高的装置,它是由物质制备和检验生成物性质两部分组成的(暂不考虑除杂、尾气的吸收),请你选用中学化学常见试剂设计一个实验,通过乙中的反应和丙中的实验现象,得出三种物质性质递变的结沦。将所用试剂名称、丙中现象及由此得出的实验结论填入下列空白处:
所用试剂:甲 、乙 、丙 。
丙中现象: 。
实验结论: 。
18.(13分)工业上用固体硫酸亚铁制取颜料铁红![]() ,反应原理是:
,反应原理是:![]()
![]()
![]() 。某研究性学习小组用下图所示装置分别检验该反应所产生的气态物质,然后利用装A瓶内的生成物来测定已分解的
。某研究性学习小组用下图所示装置分别检验该反应所产生的气态物质,然后利用装A瓶内的生成物来测定已分解的![]() 的质量。(已 知
的质量。(已 知![]() )
)
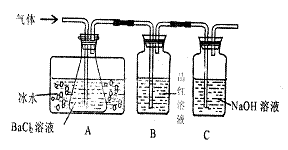 |
请回答相关问题:
(1)本实验中,A瓶所盛BaCl2:溶液可以吸收的气体是 ,发生反应的离子方程式为 。
(2)A瓶所盛的试剂的作用是 ;C瓶所盛试剂的作用是 。
(3)A瓶要用冷水冷却的原因是
.
(4)某学生欲利用装置B反应前后质量差确定已分解的![]() 质量,你认为该同学方案是否合理 (填“合理”、“不合理”),理由是
质量,你认为该同学方案是否合理 (填“合理”、“不合理”),理由是
。
(5)依据上述装置和反应事实,请设计测定己分解![]() 质量的操作和方法:
质量的操作和方法:
。
19.(12分)现有中学常见的三种单质甲、乙、丙,它们在一定条件下会发生如下变化,其中次要生成物已略去。
(1)已知乙元素的+2价离子与Ne原子具有相同的电子层结构,则②的离子方程式为 ,④化学方程式为 ;
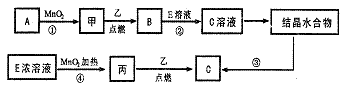 |
(2)若反应①可在常温下进行,则A的名称是 。若反应①需在加热条件下进行,则A的名称是 ,反应的化学方程式为 ;
(3)从C溶液中得到C需经过两步操作:先从C溶液中得到晶体,再将得到的晶体转化为C。从C溶液中得到晶体的过程被称为 ,将得到的晶体转化为C的实验条件是 。
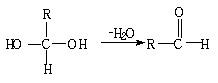 |
20.(13分)已知一个碳原子上连有两个羟基时,易发生下列转化:
请根据下图回答。
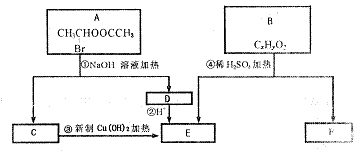 |
(1)E中含有官能团的名称是 ;③的反应类型是 ,C跟新制的氢氧化铜反应的化学方程化为 ;
(2)已知B的相对分子质量为162,其燃烧产物中![]() 则B的分子式为
,F的分子式为
。
则B的分子式为
,F的分子式为
。
(3)在电脑芯片生产领域,高分子光阻剂是光刻蚀![]() 线宽芯片的关键技术。F是这种高分子光阻剂生产中的主要原料。F具有如下特点:①能跟
线宽芯片的关键技术。F是这种高分子光阻剂生产中的主要原料。F具有如下特点:①能跟![]() 溶液发生显色反应:②能发生加聚反应;③芳环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为
。
溶液发生显色反应:②能发生加聚反应;③芳环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为
。
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有
种结构,写出其中任一种同分异构体的结构简式 。
21.(8分)向![]() 的混合稀溶液中通人足量的
的混合稀溶液中通人足量的![]() 气体,生成的沉淀的物质的量
气体,生成的沉淀的物质的量![]() 和通人
和通人![]() 气体体积(V)的关系如右图,试回答:
气体体积(V)的关系如右图,试回答:
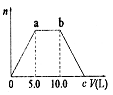 (1)a点之前的反应的离子方程式为:
(1)a点之前的反应的离子方程式为:
(2)a点到b点之问的反应离子方程式是:
(3)c点的二氧化碳体积是 L
(4)混合稀溶液中![]() 的物质的量之比为
的物质的量之比为
22.(9分)如图所示,将![]() 混合气体置于体积可变的等压容器中,在一定温度下发生如下反应:
混合气体置于体积可变的等压容器中,在一定温度下发生如下反应:![]() ,反应达到平衡状态A时,测得气体总物质的量为
,反应达到平衡状态A时,测得气体总物质的量为![]() 。若X、Y、Z的起始物质的量分别用a、b、c表示,请回答下列问题:
。若X、Y、Z的起始物质的量分别用a、b、c表示,请回答下列问题:
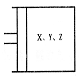 (1)达平衡状态A时,Y的转化率为 ,向达到平衡状态A的容器中通人少量Y,体系中X的体积分数 (填“增大”或“减小”或“不变”)。
(1)达平衡状态A时,Y的转化率为 ,向达到平衡状态A的容器中通人少量Y,体系中X的体积分数 (填“增大”或“减小”或“不变”)。
(2)若起始时![]() 且达到平衡后各气体的体积分数与平衡状态A相同,则起始时 b、c的取值分别为 。
且达到平衡后各气体的体积分数与平衡状态A相同,则起始时 b、c的取值分别为 。
(3)者要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时C的取值范围是 。
化学试题参考答案
1.D 2.B 3.D 4.C 5.C 6.C 7.B 8.D 9.A 10.A 11.A 12.A 13.
C 14.B 15.A 16.C
17.甲:盐酸 乙:石灰石 丙:苯酚钠溶液(每空1分,共3分)
现象:澄清溶液变浑浊(2分)
结论:酸性盐酸>碳酸>苯酚(其它合理答案均可)(2分)
18.(1)
![]() (2分)
(2分)
(2)检验生成的![]() ;吸收未完全反应的
;吸收未完全反应的![]() ,防止污染空气。(每空1分,共2分)
,防止污染空气。(每空1分,共2分)
(3)因为![]() 溶解放热,防止形成酸雾,使
溶解放热,防止形成酸雾,使![]() 吸收完全。(2分)
吸收完全。(2分)
(4)不合理,(1分)品红溶液不能将![]() 完全吸收。(1分)
完全吸收。(1分)
(5)将装置A中的沉淀过滤、洗涤、干燥、称量,依据称量结果(![]() 的质量)计算出已分解硫酸亚铁质量。(操作2分.方法2分,共4分。如果用称量A装置的质量变化来确定 已分解硫酸亚铁质量酌情给分)
的质量)计算出已分解硫酸亚铁质量。(操作2分.方法2分,共4分。如果用称量A装置的质量变化来确定 已分解硫酸亚铁质量酌情给分)
19.(1)
![]() (每空2分, 共4分)
(每空2分, 共4分)
(2)双氧水或过氧化氢;氯酸钾;![]() (方程式2分,每空1分,共4分)
(方程式2分,每空1分,共4分)
(3)结晶;(1分)在HCl气流中加热(只答加热不得分)(3分)
20.(1)羧基;氧化反应;![]()
![]()
![]() (每空1分,方程式2分,共4分)
(每空1分,方程式2分,共4分)
(2) ![]() (每空2分,共4分)
(每空2分,共4分)
⑶、⑷略
21.(1) ![]() (2分)
(2分)
(2) ![]() (2分)
(2分)
(3)15L (2分) (4)1:1(2分)
22.(1)80%(2分)减小(1分)(2)![]() (1分)c为任意值(2分);
(1分)c为任意值(2分);
(3)![]() (3分)
(3分)