吉林省实验中学2005—2006学年度高三第二次阶段测试
化 学
可能用到的相对原子质量:H—1 O—16 S—32 N—14 I—127 Ag —108
K—39 Na—23 Mg—24 Cl—35.5 Fe—56
一、选择题(每小题只有一个选项符合题意,每小题3分,共57分)
1.检验氯化氢气体中是否混有Cl2,可采用的方法是 ( )
A.用干燥的蓝色石蕊试纸 B.用干燥的有色布条
C.将气体通入硝酸银溶液 D.用湿润的淀粉碘化钾试纸
2.实验室用MnO2与浓盐酸混合加热制取Cl2,可以代替MnO2的物质为 ( )
A.酸性比MnO2更强的P2O5或SO3
B.碱性比MnO2更强的Na2O或MgO
C.氧化性比MnO2更强的KMnO4或K2Cr2O7,Ca(ClO)2等
D.还原性比MnO2更强的H2S或HI
3.下列各组离子中,能在溶液中大量共存的是 ( )
A.Mg2+、Fe3+、SO42-、Cl- B.K+、H+、Cl-、ClO-
C.K+、Ag+、NO3-、Cl- D.Ca2+、Na+、Cl-、CO32-
4.将一盛满Cl2的试管倒立在水槽中,当日光照射相当长的时间后,试管中最后剩余气体的
体积约占试管容积的 ( )
A.2/3 B.1/2 C.1/3 D.1/4
5.将Cl2通入70℃的NaOH溶液中,同时发生两个反应:
①NaOH+Cl2→NaClO+NaCl+H2O ②NaOH+Cl2→NaClO3+NaCl+H2O反应后,测得反应
①和反应②的生成物中氧化产物的物质的量之比为4:1,则被氧化和被还原的氯元素的
物质的量之比是 ( )
A.5:9 B.4:9 C.5:2 D.11:2
6.世界卫生组织(WHO)将二氧化氯ClO2列为A级高效安全灭菌剂,它在食品保鲜、饮
用水消毒等方面有着广泛应用。下列说法中正确的是 ( )
A.二氧化氯是强氧化剂 B.二氧化氯是强还原剂
C.二氧化氯是离子化合物 D.二氧化碳氯分子中氯为负价
7.下列叙述正确的是 ( )
A.氢氟酸保存在玻璃瓶中
B.AgBr保存在棕色试剂瓶中
C.氟比氯活泼,所以氢氟酸比盐酸酸性强
D.酒精是有机溶剂,能将溴从溴水中萃取出来
8.碱金属与卤素所形成的化合物大都具的有性质是 ( )
①高沸点 ②能溶于水 ③水溶液能导电 ④低熔点 ⑤熔融状态不导电
A.①②③ B.③④⑤ C.①④⑤ D.②③⑤
9.下列各组的比较中不正确的是 ( )
A.酸性:H4SiO4<H3PO4<H2SO4<HClO4 B.碱性:Be(OH)2<Mg(OH)2<KOH
C.氧化性:S<O2<F2 D.还原性:Se2-<S2-<O2-
10.检验SO2中是否含有CO2,应采用的方法是 ( )
A.通过澄清石灰水
B.通过品红溶液
C.先通过小苏打溶液,再通过澄清石灰水
D.先通过酸性KMnO4 溶液,再通过澄清石灰水
11.下列各组物质中:①Cl2O7,HClO; ②SO2,H2SO4; ③NO2,HNO3; ④SiO2,H2SiO3;
⑤Mn2O7,HMnO4,前者不是后者酸酐的是 ( )
A.②③ B.④⑤ C.①③④ D.①②③
12.不能用H2SO4来制取的气体是 ( )
A.HCl B.HF C.HBr D.H2S
13.下列各组物质中,前者是纯净物,后者是混合物的是 ( )
A.水煤气、铝热剂 B.盐酸、磷酸钙
C.硫酸铜晶体、漂白粉 D.玻璃、含Fe 为70%的氧化铁
14.都能用喷泉实验装置且烧杯溶液用NaOH溶液代替水,进行喷泉实验的气体是( )
A.HCl和CO2 B.NH3和CH4 C.SO2和CO D.SO2和NO
15.同温同压下,将等体积的N2,O2,CO2气体混合,通过过氧化钠粉末后,体积减少1/9,则此时N2,O2,CO2的分子数之比是 ( )
A.6:1:1 B.3:4:1 C.3:3:2 D.2:4:2
16.现有等体积混合而成的四组气体:①NO2+NO; ②NO2+O2; ③HCl+N2;④NO+N2,将其分别装入体积相同的试管并倒立在足量的水中,试管内水面上升的高度分别为H1,H2,H3和H4,其中高度关系是 ( )
A.H2>H3>H1>H4 B.H3>H2>H1>H4 C.H1=H2=H3=H4 D.H1>H2>H3>H4
17.化合物M溶于水,加少量AgNO3溶液有白色沉淀,如果先在M的水溶液中加一定量的苛性钠溶液,再加少量AgNO3溶液,若无沉淀生成,则M可能是 ( )
A.NH4Cl B.NaCl C.CaCl2 D.MgCl2
18.下列物质溶于冷稀H2SO4溶液中,所得溶液中(除氢元素外的其他元素体现)有氧化性的是 ( )
A.F2 B.NO C.BaO2 D.NH3
19.将充有m mLNO和n mL NO2气体的试管倒立于水槽中,然后通入m mLO2,若n>m,则充分反应后,试管中的气体在同温同压下的体积(mL)为 ( )
A.(n-m)/3 B.(4n-1)/12 C.(3m+n)/3 D.3(n-m)
二、填空题(共6分)
20.向由铁、铜组成的混合物中,加入一定量的稀HNO3,充分反应后,剩余金属m1克,再向其中加入一定量的稀H2SO4,充分振荡后,余金属m2克,则m1与m2之间的关系 。
21.在一定条件下,某元素的氢化物X可完全分解为两种单质:Y和Z。若已知:①反应的X与反应后生成的Z的物质的量之比n(x):n(z)=2:3 ②单质Y的分子为正四面体构型。请填写下列空白:
(1)单质Y是 ,单质Z是 (填写名称或分子式)。
(2)Y分子中共含 个共价键。
(3)X分解为Y和Z的化学方程式为:
三、实验题(共12分)
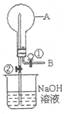
|
23.如图所示,在烧瓶中充满气体A,打
开活塞①向烧瓶中缓慢通入等体积的
气体B后关闭①,待充分反应后再打
开止水夹②。请按要求填写下表。
| 实验 序号 | 气体A | 气体B | 现 象 | A与B反应的学方程式 | |
| 打开止水 夹②前 | 打开止水 夹②后 | ||||
| ① | SO2 | H2S | |||
| ② | O2 | NO | |||
四、推断题(共15分)
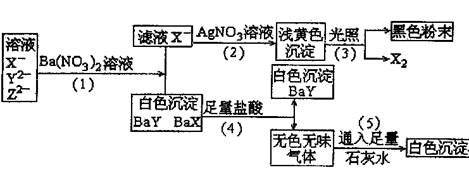
|
(1)判断X-、Y2-、Z2-分别为(写离子符号) 、 、
(2)写出①、②、③、④、⑤各步反应的化学方程式或离子方程式。
①
②
③
④
⑤
五、计算题(共10分)
25.(1)将mg铁粉和ng硫粉均匀混合,在密闭容器中加热到红热,冷却后加入多少毫升bmol/L的盐酸就不再产生气体?(用含m和b的代数式表示)若把已放出的气体收集起来,在标准状况下的体积一共是多少升?
(2)若把0.1mol 铁粉和1.6g硫粉均匀混合后,铺在石棉网上用酒精灯加热引燃,完全反应后,将残渣全部放入过量的稀H2SO4中充分反应,结果所产生的气体体积在标况下明显少于2.24L,其简述原因 。
26.2.80g铁与100mL稀硝酸混合后充分反应,产生气体为NO,反应后铁、硝酸均无剩余。向反应后的溶液中加入100mL0.2mol/L的碘化钾溶液,恰好将溶液中的Fe3+全部还原,求原硝酸溶液的物质的量浓度。
化学参考答案
一、选择题(每小题只有一个选项符合题意)
1.D 2.C 3.A 4.B 5.A 6.A 7.B 8.A 9.D 10.D
11.D 12.C 13.C 14.A 15.B 16.A 17.A 18.C 19.A
二、填空题
20.m1>m2
21. (1)白磷 氢气 (2)6 (3) 4PH3===P4+6H2
22.Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+ Mg(OH)2+2NH4+==Mg2++2NH3·H2O
23.
| 实验 序号 | 气体A | 气体B | 现 象 | A与B反应的学方程式 | |
| 打开止水 夹②前 | 打开止水 夹②后 | ||||
| ① | SO2 | H2S | 烧瓶内有水雾和黄色固体 | NaOH溶液进入烧瓶几乎充满烧瓶 | 2H2S+SO2=3S↓+2H2O |
| ② | O2 | NO | 烧瓶内气体由无色变为红棕色 | 气体由红棕色变为无色,有NaOH溶液进入烧瓶但不能充烧瓶 | 2NO+O2=2NO2 |
四、推断题
24.(1)Br-、SO42-、CO32-
(2)①Ba2++SO42-=BaSO4↓ Ba2++CO32-=BaCO3↓
②Br-+Ag+=AgBr↓
③2AgBr光2Ag+Br2
④BaCO3+2H+==Ba2++CO2↑+H2O
⑤CO2+Ca2++2OH-==CaCO3↓+H2O
五、计算题
25.(1)解:设需加入VmLbmol/LHCl
![]()
(2)铁娄在受热时与空气中的氧气反应,生成铁的氧化物,故放出的气体体积减小。
26.解n(Fe)=2.8/56=0.05mol n(Fe3+)=n(I2)=0.1×0.2=0.02mol
n(Fe2+)=0.05-0.02=0.03mol
得失电子守恒:0.03×2+0.02×3=n(NO)×3 n(NO)=0.04mol
![]()