005年江苏省启东市东南中学第一次9月考
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.共150分,考试时间120分钟.
可能用到的相对原子质量:H:1 Na:23 Mg:24 Al:27 Fe:56 K:39 Cu:64
Ag:
第I卷(选择题,共74分)
一、选择题(本题包括8个小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.随着科技的飞速发展,出现了许多新型无机材料,如植入生物体内的生物陶瓷材料HAP[化学式为
Cam(P04)n(OH)2],已被医疗上用于修补人的骨骼和牙组织,HAP的化学式中m等 于( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
2.六氟化硫分子呈正八面体,难以水解,在高电压下仍有良好的绝缘性,在电器行业有着广泛用途,但逸散到空气中会引起强温室效应。下列有关SF6的推测正确的是 ( )
A.SF6易燃烧生成二氧化硫 B.SF6中各原子均达到八电子稳定结构
C.高温条件下,SF6微弱水解生成H2SO4和HF D.SF6是极性分子
 3.分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg,该同位素的原子核内的中子数是( ) A.12 B.
3.分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg,该同位素的原子核内的中子数是( ) A.12 B.
D.用作炸药或高能材料可能是高聚氮潜在的应用
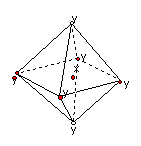
4.在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y
所围成的空间构型为正八面体型(如图)。该晶体可能为
A.NaCl B.CsCl C.CO2 D.SiO2
5.有关晶体的叙述中正确的是
A.在Si02晶体中,由Si、O构成的最小单元环每个平均占有8个原子
B.在
C.在含阳离子的化合物晶体中一定含阴离子
D.金属晶体是由金属原子直接构成的
6.下列现象或应用不能用胶体知识解释的是
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.牛油与Na0H溶液共煮,向反应后所得的溶液中加入食盐有固体析出
C.氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体
D.水泥厂、冶金厂常用高压电除去工厂烟尘,减少对空气污染
7. 以下命题,违背化学变化规律的是( )
A、石墨制成金刚石 B、水变成汽油 C、煤加氢变成人造石油 D、干冰转化成原子晶体
8.下列各组试剂在溶液中反应,当两种试剂的量发生改变时,不能用同一离子方程式边式的是( )
A.氯化镁、氢氧化钠 B.硫酸钠、氢氧化钡 C.氯化铝、氨水 D.溴化亚铁、氯水
二、选择题(本题包括10小题,第9-16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9. 下列离子方程式书写正确的是
![]() A.碳酸钠溶液显碱性:CO32- + 2H2O H2CO3
+2OH-
A.碳酸钠溶液显碱性:CO32- + 2H2O H2CO3
+2OH-
B.氯化铝溶液中加入偏铝酸钠溶液:Al3+ +3AlO2- +6H2O= 4Al(OH)3 ↓
C.氨气通入碳酸氢钠溶液中:NH3 +H+ = NH4+
D.碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2+ +2HCO3-
+2OH-= CaCO3↓+2 H2O+CO32-
10.
A、
B、此溶液中KCl的质量分数为![]()
C、
D、将此溶液蒸发部分水,再恢复到
11.下列有关说法中,错误的是
A.NH4H是一种离子晶体,其中氢离子的核外电子排布与氦原子相同
B.在石墨晶体中,碳原子与共价键的个数比为2:3
C.三种氢化物的沸点高低:HBr>HCl>HF
![]() D.CaC2的电子式为
D.CaC2的电子式为
12.下列各组离子中,一定能大量共存的是
A.加入铝粉有氢气产生的溶液中:Na+、SO42-、C1-、K+
B.pH = 0的无色溶液中:Na+、K+、MnO4-、NO3-
C.在0.1mol/L的醋酸溶液中:Fe2+、Na+、ClO-、Ca2+
D.某无色中性溶液中:Cl-、SO42-、Na+、Mg+
13.下列两种气体的分子数一定相等的是 ( )
A.质量相等、密度不等的N2和C2H4 B.等体积等密度的CO和C2H4
C.等温等体积的O2和N2 D.等压等体积的N2和CO2
14.A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是
A.X、Y、Z的稳定性逐渐减弱
B.A、B、C、D只能形成5种单质
C.X、Y、Z三种化合物的熔沸点逐渐升高
D.自然界中存在多种由A、B、C、D四种元素组成的化合物
15.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羧基硫(COS),已知羧基硫分子中所有原子均满足八电子结构,结合周期表知识,有关说法正确的是
A、羰基硫的电子式为:B、羰基硫的属于非极性分子
C、羰基硫沸点比CO2低 D、羰基硫分子中三个原子处于同一
16.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 +
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为—3
D.氮化铝晶体属于分子晶体
17.已知20oC时,CuSO4的溶解度为
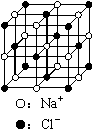 A.
A.
18.用6.02×1023表示阿伏加德罗常数的值,下列说法中正确的是
A.在SiO2晶体中,若含有1mol Si原子,则Si-O键数为4NA
B.
C.
D.用含有0.1molFeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1N
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共14分)
19.(6分)在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,有关反应的离子
方程式是_________________________;在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失,有关反应的离子
方程式是________________________________________。从以上事实可知,ClO-、I2、SO42-的氧化性由弱到强的顺
序是_____________________________。
20.(8分)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿仑尼乌斯(Arrhenius)提出了的电离理论。
(1)1905年富兰克林(Franklin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出液氨自身弱电离的方程式: 。
(2)1923年丹麦化学家布朗斯物(Brφusted)和英国化学家劳莱(Lowry)提出了质子论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。
按质子理论:下列粒子在水溶液既可看作酸又可看作碱的是 。
A.H2O B.NH4+ C.OH- D.HCO3- E.CH3COO- F.Cl-
(3)1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如:
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+
+
[∶OH ]— ![]() H∶OH
H∶OH
试指出下列两个反应中的酸或碱
① H3BO3 + H2O H+ + B(OH)4- 该反应中的碱是 (填:H3BO3 或 H2O)
NaH + H2O = NaOH +H2↑ 该反应中的酸是 (填:NaH 或 H2O)
四、(本题包括2小题,共21分)
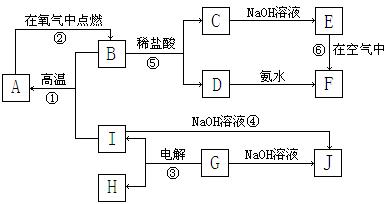 |
21.(11分)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
⑴A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置___________________。
⑵写出C、G物质的化学式。
C____________________ G______________________
⑶写出①、④、⑥反应的化学方程式。
反应①:___________________________________________________________
反应④:___________________________________________________________
反应⑥:___________________________________________________________
⑷从能量变化的角度看,①②③反应中属于△H<0的反应是___________。(填序号)
22.(10分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
|
|
| ||||||
|
|
|
| |||||
|
|
|
|
(1)上述元素的单质中熔点最高的可能是______(填字母)。
(2)![]() 和
和![]() 的化学性质相似,其原因是_____________________________________________________的缘故。
的化学性质相似,其原因是_____________________________________________________的缘故。
(3)“神舟”五号飞船内需要有一种化合物来吸收航天员呼出的![]() ,你认为该物质应该是由上表中的____
,你认为该物质应该是由上表中的____
__(填字母)元素组成的。飞船中需要制造一种适合航天员生存的人工态环境,应该在氧气中充入一种稀释气体,该气体分子式为________。
(4)在一定条件下,![]() 与
与![]() 可形成一种化合物,其晶体类型为_______;该物质溶于水后的溶液呈___
可形成一种化合物,其晶体类型为_______;该物质溶于水后的溶液呈___
__性(填“酸”、“碱”或“中”)。
(5)现有另一种元素,其原子获得一个电子所释放出能量是上表中所列元素中最大的,则X是周期表中____
族元素。
五.(本题包括2小题,共22分)
23.(10分)有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A 和B原子有相同的电子层数, 且A的最外层电子数是次外层电子数的两倍; C燃烧时呈现黄色火焰, C的单质在加热条件下与B的单质反应, 可以得到与D单质颜色相同的固态化合物;D的最高价与最低价代数和为其最低价绝对值的两倍,试根据以上叙述回答:
(1)写出A与B两元素所形成化合物的结构式为 ______________;(2分)
该化合物分子所含有的化学键属于(极性键或非极性键)______________;(1分)该化合物分子属于(极性分子或非极性分子)______________;(1分)
(2)用电子式表示C与B两元素可能形成的化合物______ _____ ;(2分)
(3)画出D的原子结构示意图 ___________________,(2分)
用电子式表示C与D两元素构成的化合物的形成过程___________________________________________。(2分)
24.(12分) 磷在氧气中燃烧,可能生成两种固态氧化物。
至反应物耗尽,并放出X KJ热量。
⑴ 通过计算确定反应产物的组成(用化学式表示)是________________,其相应的 质量(g)为______________。
⑵ 已知单质磷的燃烧热为Y KJ/mol,则1mol P与O2反应生成固态P2O5 的反应热△H = ______________________。
⑶ 写出1mol P与O2反应生成固态P2O3 的热化学反应方程式:_____________________________________________。
六、(本题包括2小题,共19分)
25.(8分)氨气极易溶于水,人们把氨气溶于水得到的溶液称为氨水。
⑴将标准状况下
⑵将上述30mL氨水与70mL2mol·L-1的AlCl3溶液混合,生成的沉淀质量为ag,求a的值。
26.(11分)将
(1)被还原硝酸的物质的量是 。
(2)判断
(3)如果
(4)如果往反应后的体系内再加入200mL 4mol/L的稀硫酸,又有气体逸出,写出离子反应方程式,并计算新产生气体的体积(标准状态)。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| A | C | C | A | C | C | B | D | BD | D | C | A | AB | CD | AD | C | D | AC |
19.(6分,各2分)ClO-+2I-+2H+=I2+Cl-+H2O;
SO32-+I2+H2O=SO42-+2H++2I-;SO42-、I2、ClO-
20.(8分,每空2分)(1)2NH3 ![]() NH4+ + NH2- (2)AD (3)H2O;H2O
NH4+ + NH2- (2)AD (3)H2O;H2O
21.⑴第四周期、第Ⅷ族 ⑵FeCl2
Al2O3 ⑶8Al+3Fe3O4![]() 4Al2O3+9Fe
4Al2O3+9Fe
2Al+2OH-+2H2O=2AlO2-+3H2↑ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
⑷①② (前3空每空1分,其他每空2分,共11分)
22.(10分)
(1)d (1分)
(2) d、g元素性质随核电荷数递增而呈周期性的变化 (2分)
(3)c、f(1分) N (1分)
(4)分子 (1分) 碱 (1分)
(5)ⅦA (1分)
23.(共8分)
(1)O=C=O; (1分) 极性键; 非极性分子(各1分)
.(2) Na2O和Na2O2的电子式;(各1分)
![]()
![]()
![]() (3)
(3)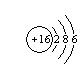 (1分)
(1分)
Na2S形成过程电子式表示(2分)
24.⑴ P2O3 P2O5
2.75 3.55
⑵ -(20X-Y) KJ/mol
⑶ P(s) + 3/4O2(g) == 1/2 P2O3(s);△H = -(20X-Y) KJ/mol
25.⑴所得氨水的物质的量浓度为:
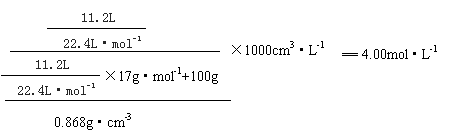
(3分)
⑵ Al3+ + 3NH3·H2O == Al(OH)3↓ + 3NH4+
1mol 3mol
0.14mol 0.12mol
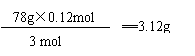 根据计算所以,Al3+ 过量。
根据计算所以,Al3+ 过量。
a= (3分)
26、(1)0.2mol(2分)
(2)Cu(1分) 0.2mol(2分)
(3)
(4)解:3Cu + 2NO3- + 8H+ = 3Cu2+ + 2NO↑+ 4H2O
n(Cu)= 0.2mol n(NO3-)= 0.4mol n(H+)= 1.6mol
∵
0.2mol×![]() < 0.4mol、0.2mol×
< 0.4mol、0.2mol×![]() < 1.6mol
< 1.6mol
∴Cu完全溶解,生成NO气体体积为:
0.2mol×![]() ×
×