江苏省清江中学高三化学月考试卷
本试卷可能用到的原子量:H:1 C:12 O:16 Na:23 N:14 S:32
第Ⅰ卷
一:选择题(每小题一个选项正确,共32分)
1.据报导我国科学家近年来研制出一种新型“连续纤维增韧”航空材料,其主要成分是由碳化硅、陶瓷和碳纤维复合而成。下列相关叙述不正确的是
A.它耐高温抗氧化 B.它比钢铁轻、硬,但质地较脆
C.它没有固定熔点 D.它是一种新型无机非金属材料
2.吸进人体内的O2有2%转化为氧化性极强的活性氧(·O·),它能加速人体衰老,因而被称为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人体内的活性氧,这时Na2SeO3的作用是
A..氧化剂 B.还原剂
C.催化剂 D.是氧化剂也是还原剂
3.进行化学实验时必须要有安全意识。下列做法错误的是
A.被玻璃割伤手后,先取出伤口里的碎玻璃片,再用稀双氧水擦洗,然后敷药包扎
B.苯酚沾在皮肤上应立即用酒精擦洗
C.温度计摔坏导致水银散落到地面上,应立即用水冲洗水银
D.酒精灯碰倒洒出酒精着火,迅速用湿抹布扑盖
4.下列说法或表示方法正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石,s)=C(石墨,s);△H=-1.90 kJ/mol可知,金刚石比石墨稳定
C.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=+285.8 kJ/mol
D.在稀溶液中H+(ag)+OH-(ag)=H2O(l);△H=-57.3 kJ/mol若将含0.5 mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ
5.下列说法不正确的是
A.胶体能够稳定存在的主要原因是:同种胶体微粒带有同种电荷
B.水的沸点在同族元素形成的氢化物中最高是因为水分子间能形成氢键
C.二氧化硫和乙二酸都能使溴水褪色,但原理不同
D.胆矾晶体结晶水的测定中,若加热不充分或加热后的固体不放在干燥器中冷却,测得的结晶水值偏小
6.化学与生活是紧密相联的,下列关于生活化学的说法正确的是
A.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常放入生石灰。
B.现在用的清洁燃料主要有两类:一类是压缩天然气,另一类为液化石油气,他们属于碳氢化合物
C.福尔马林是一种良好的杀毒剂,也可用来消毒自来水
D.保护加酶洗衣粉的洗涤效果,应在热水溶解洗衣粉
7.日常生活、工农业生产、科学研究涉及许多化学原理,那么下列有关说法正确的是
A.实验室可以用浓硫酸和氯酸钾制氯气
|
B.2MgO=== 2Mg+O2↑符合冶炼原理
C.除去乙二酸乙二酯中的少量乙二酸和乙二醇,可以用饱和碳酸钠溶液
D.在工业制NH3、HNO3、H2SO4设备中,都用了吸收塔
8.关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,
可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,
可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,
可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,
则原溶液中一定有大量CO32-
二:选择题(每小题有1~2个选项正确,共42分,其中17、18小题每小题5分)
9.“混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐。“复盐”是指含有多种简单阳离子和一种酸根阴离子构成的盐如KAl(SO4)2,下列各化合物中属于混盐的是
A.CaOCl2 B.(NH4)2Fe(SO4)2 C.BiONO3 D.K3[Fe(CN)6]
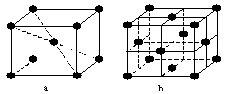 10.在1 183 K以下纯铁晶体的基本结构单元如a所示,在1183 K以上转变为b所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。下列说法中正确的是:
10.在1 183 K以下纯铁晶体的基本结构单元如a所示,在1183 K以上转变为b所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。下列说法中正确的是:
A.a型属于CsCl晶胞,b型属于NaCl晶胞
B.纯铁由于存在两种晶胞,因此它有两种不同的熔点
C.a型中的铁原子表面利用率低于b型,
D.上述纯铁晶体转变温度(1 183 K以下和以上)前后两者的密度比![]()
11. 下列各组离子在相应的条件下一定能大量共存的是
A.在强碱性溶液中:CO32-、K+、C1-、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42-
C.在c(H+)/c(OH-)= 1×1013的溶液中:NH4+、Ca2+、C1-、K+
D.在中性无色溶液中:Fe3+、C1-、NO3-、A13+
12.下列反应的离子方程式正确的是
A.草酸和少量烧碱溶液:H2C2O4+OH-=HC2O4-+H2O
![]() B.硫氢化钠的水解: HS-+H2O
H3O++S2-
B.硫氢化钠的水解: HS-+H2O
H3O++S2-
![]() C.铁作电极电解饱和食盐水:2Cl-+2H2O 2OH-+H2↑+Cl2↑
C.铁作电极电解饱和食盐水:2Cl-+2H2O 2OH-+H2↑+Cl2↑
D.醋酸洗涤铜器表面的碱式碳酸铜:
Cu2(OH)2CO3 +4H+ =2Cu2++CO2↑+3H2O
13.NA为阿伏加德罗常数,下列说法正确的是
A.常温下lmol氯气与熟石灰完全反应转移电子数为2NA
B.22g二氧化碳中含有的共用电子对数目为2NA
C.1L 0.5mol/L的乙酸溶液中乙酸分子数约为0.5NA
D.20g重水(D2O)中的中子数为8NA
14.现有Na2CO3、H2SO4、Ba(OH)2三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,出现沉淀后过滤,再将滤液与第三种溶液混合起来,最终所得的溶液
A.一定呈酸性 B.可能呈碱性 C.可能呈中性 D.一定呈中性
15.下列操作或实验数据记录正确的是
A.1mol/L的AgNO3溶液和1mol/L的KI溶液混合制碘化银胶体
B.用标准NaOH溶液滴定未知浓度的盐酸用去NaOH溶液23.10mL
C.用pH试纸测得氯水的pH为2
D.在试管中制备Fe(OH)2时,将吸有NaOH的滴管插入到FeSO4溶液的试管底部
16.用惰性材料作电极,分别电解下列物质,当通过相同电量时,下列指定的电极上析出气体质量最大的是
A.NaOH溶液(阴极) B.NaCl溶液(阴极)
C.熔融的NaCl(阳极) D.Na2SO4溶液(阳极)
17..某研究性学习小组想用实验证明高锰酸钾溶液的紫红色是MnO4-离子的颜色,而不是K+离子的颜色,他们设计的下列实验步骤中没有意义的是
A. 将高锰酸钾晶体加热分解,所得固体质量减少
B.观察氯化钾溶液没有颜色,表明溶液中K+无色
C.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+无反应
D.在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明MnO4-离子为紫红色
18.现有一瓶失去标签的纯净铵盐,是(NH4)2SO4、NH4Cl、NH4NO3、
NH4HCO3中的一种,为测定其中的含氮量可以采用甲
醛法4NH4++6HCHO→(CH2)6N4+4H++6H2O。现在称取2 g该铵盐溶于水,加入足量的甲醛溶液后,再加入水配成100 mL溶液,取出10 mL,滴入酚酞后再逐滴滴入0.1 mol·L-1的NaOH溶液,当滴到25 mL时溶液呈粉红色,且在半分钟内不褪色,则该铵盐中氮的质量分数是
(A)17.5% (B)17.7% (C)21.2% (D)35%
第二卷(共76分)
三(本大题共二小题,22分)
19、某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
![]()
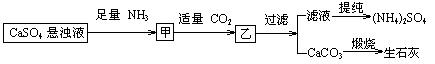
(1)下列推断不合理的是
A.往甲中通CO2有利于(NH4)2SO4生成 B.生成1mol(NH4)2SO4至少消耗2 NH3
C.CO2可被循环使用 D.直接蒸干滤液能得到纯净的(NH4)2SO4
(2)1、2操作顺序能否颠倒?理由是
(3)3操作中使用的玻璃仪器名称为
20、某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
⑴上述实验步骤中需要使用玻璃棒的是_______________(填实验序号),步骤①、③中研磨固体所用仪器的名称是___________________;
⑵步骤③中洗涤沉淀的操作是___________________________________________
(二)证明氧化铜能加快氯酸钾的分解并
与二氧化锰的催化效果进行比较,用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
| ④ | 1.2 g | 无其他物质 | |
| ⑤ | 1.2 g | CuO 0.5 g | |
| ⑥ | 1.2 g | MnO2 0.5 g |
回答下列问题:
⑶上述实验中的“待测数据”指_____________;
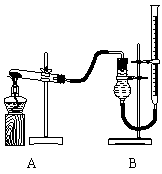 ⑷本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管;
⑷本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管;
⑸若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,______________________________________________________________________________________________;
⑹为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a._______________________________,b.CuO的化学性质有没有改变。
四:本大题共4小题36分
21、2003年10月17日晨6时许,载着航天英雄杨利伟的“神舟”五号飞船在内蒙古大草原成功着陆,我国首次载人航天飞行取得圆满成功。发射“神舟”飞船的长征2号火箭用了肼(N2H4)作燃料,N2H4与NH3有相似的化学性质。
(1)写出肼与盐酸反应的离子方程式 。
(2)拉席希法制备肼,是将NaClO和NH3按物质的量之比1:2反应生成肼,试写出该反应的化学方程式 。该反应中 是氧化产物
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4g N2H4(g)在上述反应中放出71kJ的热量,写出热化学方程式 __ 。
22、下图是中学化学中常见的物质间化学反应关系的图示,其中A的焰色反应呈黄色,E、F为有刺激性气味的气体,G为强酸性溶液,
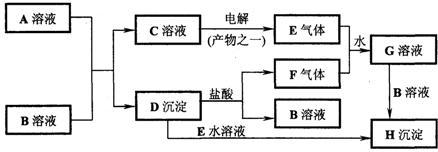
试回答:
(1)写出化学式:A_______________;B_______________。
(2)写出下列反应的离子方程式:
①C→E:______________________________;
②D→H:______________________________;
③E+F+H2O→G:______________________________
23、(1)含有微量二价锰盐的溶液,在浓硝酸中与PbO2混合煮沸,溶液即呈紫红色,PbO2转化为Pb(NO3)2,反应中没有气体生成。该反应的离子方程式是: 。
(2)已知Br2、Fe2(SO4)3、CaC2等物质均能和水发生反应,生成两种物质。下表中所列四种物质都易与水反应。
①在表中空格处填写各物质分别与水反应的产物中,属于氧化物对应水化物的化学式
| Li3N | ClF | NaNH2 | Mg2Si |
②写出这四种物质与水反应的产物中,溶于水形成无氧酸的物质的电子式
24、石灰氮(固体甲)是一种古老而多用途的有效肥料,它很容易用廉价的普通化学品乙来生产,乙高温加热分解产生白色固体A和无色气体B,后者不支持燃烧。用碳高温还原A生成灰色固体C和气体D,C和D能进一步氧化,且C必须密封保存,否则遇潮湿空气即产生含碳质量分数最高的常见气态烃,C与氮气反应,最终生成固体甲。经测定固体甲由三种元素组成,其中钙元素占50.00%、碳占15.00%(元素质量分数)
(1)完成下列合成固体甲的反应方程式:
|
①乙—————→A+B
②A+碳——→C+D
③C+氮气——→甲+单质
(2)写出固体甲水解的反应方程式 。
五:本大题共二小题,18分
25、为测定某氧化物(化学式为MO)中金属M的相对原子质量,做以下实验:称取该氧化物8.0g溶于适量的稀硫酸中,再配制成250.0mL溶液。取该溶液50mL用惰性电极进行电解,当溶质刚好电解完全时,电极上析出M 1.28g。请通过计算回答下列问题:
(1)金属M的相对原子质量是多少?
(2)若此电解质在电解后体积为40mL,此时溶液的pH值是多少?
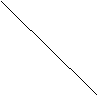
26、某化工厂以硫磺为原料生产硫酸.设空气中的氧气的体积分数为0.20,且不考虑各生产阶段的物料损失.试完成下列各题:
(1)如果该厂生产98%的硫酸10t。
①需要原料硫磺的质量是________________t。
②需要消耗空气的体积(标准状况)为________![]() 。
。
(2)如果该厂每天生产98%的硫酸at,在生产过程中为了使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求硫燃烧后的混合气体中氧气的体积分数为b。已知该厂每天消耗空气2.24×![]() (标准状况)。
(标准状况)。
①写出a和b的关系式。
②在图中画出a和b的关系曲线。
江苏省清江中学高三化学月考试卷答案纸
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
三:
19、(1)
(2)
(3)
20(1) 、
(2)
(3) 。(4)
(5)
(6)a
四:
21(1)
(2) 、
(3)
22、
(1)A B、
(2)
①
②
③
23、
(1)
(2)①
| Li3N | ClF | NaNH2 | Mg2Si |
②
24、(1)
①
②
③
(2)
五:
25:M= pH=
26、(1)
① ②
(2)
 (3)
(3)
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| B | B | C | D | C | B | C | C | A |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| CD | AC | A | B | BC | BD | C | A | D |
19、(1)D (2)不能,CO2溶解度小,NH3溶解度大,有利于生成HCO3-
(3)烧杯、玻璃棒、漏斗
20、(1)①②③、研钵
(2)用适量水洗涤2—3次
(3)生成25ml氧气的时间、(4)碱式
(5)用余烬的木条检验之
(6)氧化铜的质量不变
21、(1)H++N2H4+=N2H+5
(2)2NH3+NaClO= N2H4↑+NaCl+H2O
(3)N2H4(g)+NO2(g)=3/2N2(g)+2H2O(g); △H=-568kJ/mol
22、(1)、Na2SO3 BaCl2或CaCl2
电解
(2)2Cl-+2H2O======Cl2↑+H2↑+2OH-
(3)BaSO3+ Cl2+H2O === BaSO3 +2Cl-+2H+
(4)Cl2+H2O+SO2===2Cl-+4H++SO42-
23、(1)5PbO2+4H++2Mn2+=5Pb2++2MnO-4+2H2O
24、(1)CaCO3+![]() CaO+CO2↑
CaO+CO2↑
(2) CaO+3C===CaC2+CO↑
(3)CaC2+N2==CaCN2+C
(4)CaCN2+3H2O===CaCO3↓+2NH3↑
 25、64 0
25、64 0
26、(1)3.2t 16800m3
![]() (2)a=20-100b
0.067<b<0.2
(2)a=20-100b
0.067<b<0.2
![]()
![]()
![]()
![]()
![]()
![]()
![]() (3)
(3)