江苏省太仓高级中学
2006届第一次月考化学试题
江苏省太仓高级中学 唐加林
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Al—27 S—32 C1—35.5 Mn—55 Fe—56 Zn—65 Ag—108 Ba—137
第Ⅰ卷(共74分)
一、 选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意):
1、随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止富脂食品氧化变质,延长食品的保质期,在包装袋中常放入抗氧化性物质,下列不属于抗氧化性物质的是( )
A、生石灰 B、还原铁粉 C、亚硝酸钠 D、维生素C
2、对于非典型肺炎病人住过的房间,可用15%的过氧乙酸(![]() )溶液按7mL/m2熏蒸2h进行消毒。下列有关过氧乙酸的叙述错误的是(
)
)溶液按7mL/m2熏蒸2h进行消毒。下列有关过氧乙酸的叙述错误的是(
)
A、常温下,其水溶液有酸性 B、具有氧化性
C、属于烃类衍生物 D、是非电解质
3、“混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙 [Ca(NO3)Cl]就是一种混盐。“复盐”是指含多种简单阳离子和一种酸根阴离子构成的盐,如:KAl(SO4)2 。下列化合物中属于“混盐”的是( )
A、CaClOCl B、(NH4)2Fe(SO4)2 C、BiONO3 D、K3Fe(CN)6
4、设NA表示阿伏加德罗常数,下列说法不正确的是( )
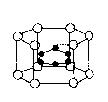
A、1molCnH2n+2中含有(2n+1)NA个共价键
B、1mol石墨中含有NA/2个六碳环
C、常温常压下31g 白磷与红磷混和物,含有NA个磷原子
D、将1molNO2气体进行加压,加压后气体的分子数将少于NA个
5、约翰·芬恩等三位科学家因在蛋白质等大分子研究领域的杰出贡献获得了2002年的诺贝尔化学奖。下列有关说法正确的是( )
A、蚕丝、羊毛、棉花的主要成分都是蛋白质
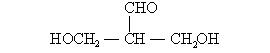
B、蛋白质溶液不能产生丁达尔现象
C、蛋白质溶液中通入CuSO4溶液产生盐析现象
D、蛋白质在紫外线的照射下将会失去生理活性
6、可逆反应3A(g)![]() 3B+C, △H>0,随着温度的升高,气体的平均相对分子质量有变小的趋势。下列关于B、C两种物质的聚集状态的判断不正确的是
3B+C, △H>0,随着温度的升高,气体的平均相对分子质量有变小的趋势。下列关于B、C两种物质的聚集状态的判断不正确的是
( )
A、B和C可能都是气体 B、B和C一定都是气体
C、若C为固体,由B一定是气体 D、有可能B为固体,C为气体
7、氢叠氮酸(HN3)与醋酸酸性相近,其盐稳定,但撞击发生爆炸产生氮气,有关叠氮酸的叙述:①NaN3的水溶液呈碱性②HN3的固体属于分子晶体③NaN3的固体属于离子晶体④NaN3的固体可用于小汽车防撞保护气囊。其中正确的是( )
A、①②③ B、②③④ C、①③④ D、全对
8、咖喱是一种烹饪辅料,若白衬衣被咖喱汁玷污后,用普通的肥皂洗涤时,会发现黄色污渍变为红色,经水漂洗后红色又变黄色。据此现象,你认为咖喱汁与下列何种试剂可能有相似的化学作用( )
A、品红溶液 B、石蕊溶液 C、氯水 D、碘化钾—淀粉溶液
二、 选择题(本题包括10小题,第9-16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9、据报道,某地一辆装载有砒霜的货车因故滑下河道,部分砒霜散落到河中。砒霜的主要成份是 As2O3,剧毒,可用于制造杀虫剂和灭鼠剂等。As2O3是两性偏酸性氧化物,其无色晶体在193℃升华,微溶于水生成H3AsO3;其对应的盐也有毒性,其中碱金属对应的盐易溶于水,其它金属对应的盐几乎不溶于水。根据以上信息,下列说法正确的是( )
A、As2O3是砷的最高价含氧酸的酸酐
B、As2O3的晶体为分子晶体
C、可向河水中投入纯碱,以消除对河水的污染
D、可向河水中撒入生石灰,以消除对河水的污染
10、已知甲醛分子中4个原子是共平面的。下列分子中所有原子不可能同时存在于同一平面上的是( )
A、CH2=CH —CH=CH2 B、![]()
![]()
C、CH3CHO D、
11、根据环保要求,下列各组中的两种溶液能倒在同一废液缸中的是( )
A、盐酸和氢氧化钠 B、硫酸铵和氯化钡
C、硝酸亚铁和盐酸 D、亚硫酸钠和硫酸
12、L—多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下:
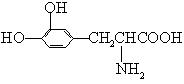
下列关于L—多巴性质的推测正确的是( )
A、不可能形成高分子化合物 B、不易氧化
C、只有酸性 D、能与溴水发生取代反应
13、下列离子方程式书写正确的是( )
A、铝与氢氧化铝溶液反应:Al+2OH- = AlO2- +H2↑
B、偏铝酸钠溶液中加入氯化铝:Al3++3AlO2- +6H2O = 4Al(OH)3↓
C、醋酸去除水垢:CaCO3 +2H+ = Ca2+ +CO2↑+H2O
D、等体积等物质的量浓度的碳酸氢钠溶液与氢氧化钡溶液混和:
Ba2+ +2OH- +2HCO3- =BaCO3↓+CO32- +2H2O
14、下列各组离子在溶液中能大量共存,加入Fe2(SO4)3后仍能大量共存的是( )
A、Na+、I-、CO32-、ClO- B、Fe2+、H+、K+、NO3-
C、Ba2+、Na+、SCN-、Cl- D、Cu2+、Mg2+、Cl-、NO3-
15、某学生利用厨房中的用品进行家庭小实验研究,现有:鸡蛋壳、食醋、纯净水、食盐、干电池、石墨电极及导线,你认为不能完成的家庭小实验有( )
A、除去鸡蛋白中的少量食盐 B、自制家用含次氯酸钠溶液的消毒剂
C、检验碘盐中是否含有碘酸钾 D、除去热水瓶胆内的水垢
16、已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,且其离子浓度的大小顺序为:c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则原溶质可能为( )
A、CH3COONa B、CH3COONa、NaOH
 C、CH3COOH、CH3COONa D、CH3COOH、NaOH
C、CH3COOH、CH3COONa D、CH3COOH、NaOH
17、2001年世界十大科研成果之一是日本科学家发现了硼镁形成的化合物,该化合物刷新了金属化合物超导温度的最高记录。下图示意的是该化合物的晶体结构单元,每单元镁原子间形成正六棱柱,且棱柱的上下底面各有一个镁原子;6个硼原子位于棱柱内。则该化合物的化学式为( )
A、Mg2B B、MgB2 C、Mg3 B2 D、MgB
18、分子式为C4H8O3的有机物,在一定条件下具有下列性质:①在浓H2SO4存在条件下,能分别与CH3CH2OH或CH3COOH反应 ②在浓H2SO4存在条件下,也能脱水生成一种只存在一种结构形式,且能使溴水褪色的物质③在浓H2SO4存在下,还能生成一种分子式为C4H6O2的五元环状物。根据上述性质,确定C4H8O3的结构简式为为( )
A、HOCH2COOCH2CH3 B、CH3CH(OH)CH2COOH
C、HOCH2CH2CH2COOH D、CH3CH2CH(OH)COOH
第Ⅱ卷 (非选择题共76分)
三、(本题包括2小题,共22分)
19、(10分)为了测定实验室长期存放的Na2SO3固体的纯度,某化学活动小组设计了多种实验方案。准确称取W g固体样品,配成250mL溶液。分成三组进行实验:
甲组:量取25.00mL上述溶液,加入足量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g
乙组:量取25.00mL上述溶液,加入足量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g
丙组:量取25.00mL上述溶液,用a
mol/L 的酸性KMnO4溶液进行滴定。(![]() ),消耗KMnO4溶液b mL。
),消耗KMnO4溶液b mL。
(1) 配制250mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管和 。
(2) 在丙组实验中滴定时是否需要选择指示剂? (填“需要”或“不需要”)。滴定终点的颜色变化是 。
(3) 用丙组的实验数据,计算Na2SO3的纯度 。
(4) 实验中发现,乙组同学测定的Na2SO3纯度比甲组和丙组同学的结果都要低。试分析产生上述现象的原因
。
20、(12分)某研究性学习小组,在做Na2O2与水反应实验时,发现Na2O2与水反应后的溶液中滴加酚酞试液溶液呈现红色,但红色很快褪色,甲、乙、丙三同学对此现象分别做了如下推测:
甲:因为反应后试管很热,所以可能是溶液温度较高使红色褪去。
乙:因为所加水的量较少,红色褪去可能是生成的NaOH溶液浓度较大的影响。
丙:Na2O2具有强氧化性,生成物中O2、H2O2(可能产物)等也具有强氧化性,氧化漂白了红色物质。
(1)验证甲同学的推测是否正确的方法是_______________________,验证乙同学的推测是否正确的方法是 ,当出现 现象时,即说明丙同学的推测正确。
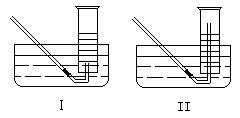 (2)有同学提出用定量的方法探究丙同学方案中是否含有H2O2,其实验方法为:称取2.6gNa2O2固体,使之与足量的水反应,测量产生O2的体积,与理论值比较,即可得出结论。
(2)有同学提出用定量的方法探究丙同学方案中是否含有H2O2,其实验方法为:称取2.6gNa2O2固体,使之与足量的水反应,测量产生O2的体积,与理论值比较,即可得出结论。
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用右图装置中的 ,理由是____ 。
②若在标准状况下测量气体的体积,应选用量筒的大小规格为 (选填“100mL”、“200mL”、“500mL”或“1000mL” )。
四、(本题包括2小题,共18分)
21、(12分)已知A为酸式盐,B为某二价主族金属元素的化合物,常温常压下C、D、F、G、I均呈气态。等物质的量A、B与少量的水充分混合能恰好完全反应。图中反应条件(除高温外)均已略去。
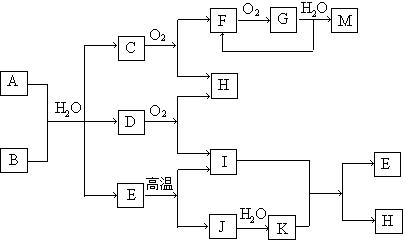
(1)写出B的电子式 ,D的结构简式 。
(2)写出A与B反应的化学方程式 。
(3)如对气体G进行加压操作,产生的现象是 。
(4)写出下列反应的离子方程式:
①在A溶液中加入M 。
②向A溶液中加入过量NaOH溶液,并加热 。
22、(6分)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同主族元素;已知B、D两元素原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体。
(1) 写出B、C两元素所形成的原子个数比为1:1的化合物的电子式
(2) C和D可形成一种新型的熔盐电池,电池反应可写作:
![]() ,其正极的电极反应式为
。
,其正极的电极反应式为
。
(3) 由A、B、C、D四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,该化合物的化学式为 。
五、(本题包括2小题,共18分)
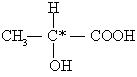 23、(8分)在有机物分子中,常把连有四个不同原子或原子团的碳原子称为
23、(8分)在有机物分子中,常把连有四个不同原子或原子团的碳原子称为
“手性碳原子”,可用“C*”标记。如: 含有生命活性
的物质不少都含有“手性碳原子”。 具有某些光学活性的有机分子中必含有“手性碳原子”。某新合成的化合物A经测定具有光学活性,其结构简式为:
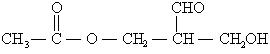
若通过适当的反应使A失去光学活性,请回答下列问题:
(1) 保持A分子中碳原子数不变(两种方法):
①有机反应类型: 反应,对应有机物的结构简式:
②有机反应类型: 反应,对应有机物的结构简式:
(2)使A的分子中碳原子数增加2:
有机反应类型: 反应,对应有机物的结构简式:
(3)使A的分子中碳原子数减少2:
有机反应类型: 反应,对应有机物的结构简式:
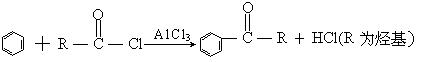
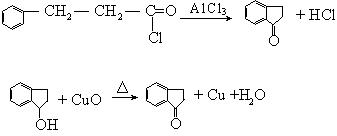
24、(10分)已知“傅—克反应”为:
下面是由苯制有机物“茚”的反应过程(省去了若干步骤):
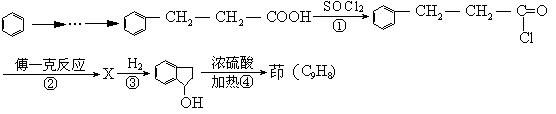 (1)上述①②③④反应中,属于取代反应的有
。
(1)上述①②③④反应中,属于取代反应的有
。
(2)化合物X与茚的结构简式是:X ,茚 。
(3)写出下列反应的化学方程式:
反应② 。
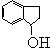
将弯成螺旋状的铜丝放在氧气中灼烧后伸入 中。
。
六、(本题包括2小题,共18分)
25、(8分)环保检测中,有害气体的浓度常用1L气体中有害气体的毫克值(mg/L)来表示,对某气体样品中所含CO的浓度进行测定,其方法和实验步骤如下:①首先将2.00L的气体样品通入盛有I2O5固体的加热管,反应后生成CO2和I2;②用30.00mL5.00×10-3mol/L的Na2S2O3溶液吸收所产生的碘,反应方程式为:I2+2S2O32- = 2I- +S4O62-;③将②中溶液取出1/5,加入1.00mL 1.00×10-2mol/L碘水,正好将该溶液中过量的Na2S2O3完全氧化。
(1) 写出步骤①中CO通过盛有I2O5的加热管的有关化学方程式。
(2)计算样品中CO的浓度。
26、(10分)有机物A是烃或烃的含氧衍生物,其分子中碳原子数少于5,取0.05molA在0.2molO2中燃烧,在101℃和1.01×105Pa条件下,将生成的混合气体依次通过足量的无水氯化钙和足量的碱石灰吸收,减少的气体体积比为2:1,剩余的气体在标准状况下体积为2.24L。填写下列表格(空格不一定填满)。
| A可能的分子式 | 2.24L气体可能的成分 | |
| (1) | ||
| (2) | ||
| (3) |
江苏省太仓高级中学
2006届第一次月考化学试题参考答案
江苏省太仓高级中学 唐加林
第Ⅰ卷(共74分)
一、 选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意):
1、A(还原铁粉、亚硝酸钠、维生素C都可作还原剂)
2、D(过氧乙酸的杀菌主要是由于其有氧化性)
3、A(B:为复盐,C中负二价氧不是酸根,D为络合物)
4、A(A:应是3n+1个共价健;B:石墨中一个六碳环相当于2个碳原子;C:根据P原子守恒;D:NO2加压后有一部分变成N2O4)
5、D(A:棉花是纤维素;B:蛋白质溶液能产生丁达乐现象;C蛋白质遇CuSO4会变性;D:蛋白质遇紫外线变性)
6、B(升高温度,平衡向正反应方向移动。A:B、C都是气体时,气体总质量守恒,物质的量增大,平均相对分子质量减小;B:若B为固体,C的分子量比较小时,也符合题意,故B答案不成立;B、C中至少有一种是气体,否则气体的平均相对分子质量就不变了,故答案C和D是成立的。)
7、D(NaN3与水反应生成NaOH与HN3,故溶液呈碱性;少量NaN3的固体受撞击时产生N2,故可作小汽车的保护气囊)
8、B(肥皂水呈碱性,咖喱与其变色类似于酸碱指示剂)
二、选择题(本题包括10小题,第9-16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9、BD(As2O3中砷显+3价,不是砷的最高价态;砷为非金属,故As2O3属分子晶体;碱金属的H3AsO3盐易溶于水,故加纯碱不能消除污染)
10、CD(因甲基是立体结构,C和D中都含甲基,不可能为平面结构)
11、AB(硝酸亚铁和盐酸会反应产生氮的氧化物,亚硫酸钠和硫酸会产生污染物SO2)
12、D(“L—多巴”有氨基与羧基,能通过缩聚反应形成高聚物,既有酸性,又有碱性。它含有酚羟基,故易被氧化,也易与溴水发生取代反应)
13、B(A电荷不守恒;C中醋酸是弱酸,不能改写成H+,D应是1:1物质的量比反应)
14、D(A中I-与ClO-不能共存;B中Fe2+、H+、NO3-三者不能共存;C中加Fe3+后不能与SCN-共存)
15、C(A可用鸡蛋壳做半透膜;B电解饱和食盐水可得含次氯酸钠溶液的消毒剂;D用醋可除水垢)
16、BD(OH-浓度大于CH3COO– 浓度,A、C二种情况不可能成立)
17、B(形成正六棱柱的12个镁原子,每个为六个六棱柱共用,只算2个镁原子,棱柱上下底的两个镁原子,每个为两个六棱柱共用,算1个镁原子,所以镁原子共3个;而6个硼原子在棱柱内部,算6个硼原子。故化学式为MgB2)
18、C(既能与乙醇反应,又能与乙酸反应,说明该有机物中既有—OH,又有
—COOH;脱水只生成一种烯烃,结构为C或D;根据能形成五元环,
故选C)
第Ⅱ卷(共76分)
三、(本题包括2小题,共22分)
19、(10分)
(1)(2分)托盘天平、250mL的容量瓶
(2)(4分)不需要;紫色不褪色。
(3)(2分)![]()
(4)(2分)盐酸提供H+,Ba(NO3)2提供NO3- 形成稀HNO3,将一部分SO32-氧化成SO42-,遇Ba2+结合生成BaSO4沉淀。
20、(12分)
(1)(每空2分)冷却后看溶液是否变红;加水稀释后看溶液是否变红;冷却后或加水稀释后均不变红。
(2)(每空2分)①Ⅱ;防止气体冷却时出现倒吸现象
②500mL
四、(本题包括两小题,共18分)
21、(12分)(每空2分)
![]()
(1)
;CH![]() CH
CH
(2) CaC2 + NH4HCO3 = NH3↑+C2H2↑+CaCO3↓
(3) 气体的红棕色先变深后变浅
(4) ①HCO3- +H+ = H2O +CO2↑
②NH4+ +HCO3- +2OH- = NH3↑+2H2O+CO32-
22、(6分)(每空2 分)
![]()
(1)
(2) xS+2e- = Sx2-
(3) NaHSO3
五、(本题包括2小题,共18分)
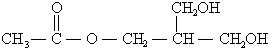 23、(8分)(每空1分)
23、(8分)(每空1分)
(1)①加成反应;
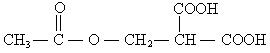
②氧化反应;
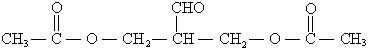
(2)酯化反应;
(3)水解反应:
24、(10分)
(1)①②(2分)
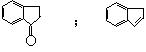
(2)(4分)
(3)(4分)
六、(本题包括2小题,共18分)
25、(8分)
(1) 5CO + I2O5 = 5CO2 + I2 (1分)
(2) I2 + 2S2O32- =2I- +S4O62- (1分)
由题意知:过量的Na2S2O3的物质的量为:
1.00×10-3L×1.00×10-2mol/L×5×2=1.00×10 – 4 mol (2分)
样品中CO与I2O5反应生成I2的物质的量为:
(30.00×10-3L×5.00×10-3mol/L – 1.00×10- 4mol) / 2=2.50×10-5 mol (2分)
样品中CO的浓度为:![]() (2分)
(2分)
26、(10分)
(1) CH4 (2分);O2 (2分)
(2) C4H8O2 (3分);CO(3分)
分析:剩余0.1mol气体为氧气或一氧化碳。
若剩余气体为氧气,则有机物中碳氢个数比一定为1: 4,组成符合(CH4)xOy,x只能为1,计算只有CH4符合。
若剩余气体为CO,有机物组成符合C2(CH4)xOy,燃烧反应方程式为:
C2(CH4)xOy + 4O2 → 2CO+xCO2+ 2xH2O
若x=1,则y= -2 无解
若x=2,则y=2 分子式为C4H8O2
若x=3,则碳原子数为5,不符合题意。