揭阳市高三化学月考试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷问(非选择题)两部分,共150分。考试用时120分钟。
第Ⅰ卷(选择题 共67分)
可能用到的相对原子质量:H:1 Mg:24 C:12 O:16 S:32 Cl:35.5 Br:80 Na:23 Al:27 K:39 Fe:56 Cu:64 Ag:108
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
1、下列物质中,其水溶液能导电、溶于水时化学键被破坏,且该物质属于非电解质的是
A.I2 B.BaCO3 C.CO2 D.C6H12O6(葡萄糖)
2、核内质子数不同,核外电子数相同的两种微粒,它们可能是
A.同种元素的两种离子 B.同种元素的原子和离子
C.不同元素的离子 D.不同元素的原子
3、CCTV《科技博览》报道,2004年3月中科院首创用CO2合成可降解塑料聚二氧化碳。下列相关说法合理的是
A、 二氧化碳塑料是通过加聚反应制得的
B、二氧化碳塑料与干冰互为同素异形体
C、二氧化碳塑料与干冰都是纯净物
D、二氧化碳塑料的使用会产生白色污染
4、下列能够检验出KI中是否含有Br一的实验是
A.加入足量的新制氯水,溶液变色则有Br—
B.加入酸性KMn04溶液,观察溶液颜色是否褪去
C.加入少量的碘水,再加入CCl4振荡,有机层有色,则有Br—
D.加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br一
5、运用元素周期律分析下面的推断。其中错误的是
A.铍的氧化物的水化物可能有两性
B.砹为有色固体;HAt不稳定;AgAt感光性很强,不溶于水也不溶于稀硝酸
C.硫酸锶是难溶于水的固体
D.硒化氢是无色、有毒、比H2S稳定的气体
6、在pH=0溶液中,下列各组离子因发生氧化还原反应而不能大量共存的是
①Ag+、Ca2+、Cl-、CO32—②Cl-、S2O32—、K+、Na+③Fe2+、Na+、K+、NO![]() ④K+、Na+、Br-、Cl-⑤Fe3+、Na+、S2—、Cl—⑥S2—、Na+、SO32—、K+
④K+、Na+、Br-、Cl-⑤Fe3+、Na+、S2—、Cl—⑥S2—、Na+、SO32—、K+
A、①③④⑤ B、②③⑤⑥ C、①②③⑤ D、全部
7、下列物质固态时熔点的比较正确的是
A.F2>Cl2>Br2 B.金刚石>NaCl>02
C.S>NaBr>金刚石 D.Na>CH4>冰
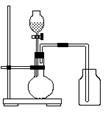 8、利用下列各组中物质作用制备和收集少量气体,能采用右图实验装置的是
8、利用下列各组中物质作用制备和收集少量气体,能采用右图实验装置的是
(1)锌和稀硫酸(2)电石和水(3)过氧化钠和水(4)亚硫酸钠和硫酸 (5)铜和稀硝酸(6)浓硫酸和浓盐酸
A.仅(3)、(4)、(6) B.(4)、(5)
C.仅(2)、(3)、(5)、(6) D.全部
9、下列说法中正确的是
A.C60气化和I2升华克服的作用力相同
B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
C.氯化钠和氯化氢溶于水时.破坏的化学键都是离子键
D.用作高温结构陶瓷材料的Si3N4固体是分子晶体
二.选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项。只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
10、下列褪色过程不是因为氧化还原反应而褪色的是
A.SO2气体通入到溴水中使溴水褪色
B.氯水使滴有酚酞的NaOH溶液褪色,加入NaOH后不变红
C.乙二酸能洗去溅在布条上的蓝墨水
D.在含有碘单质的淀粉溶液中,加入KOH溶液后蓝色褪去
11、下列有关叙述正确的是
①已知NaH是离子化合物,则其电子式是 Na+[:H]-
②在PCl5分子中,磷原子满足最外层8电子结构
③在BCl3分子中,所有原子都满足最外层8电子结构
④石墨晶体是层状结构,在同一层上平均每个正六边形所含有的碳原子数为2
⑤离子化合物中可能含有共价键⑥CaO2晶体中阴离子与阳离子数目之比为1∶1
A、①③⑤⑥ B、①④⑤⑥ C、③④⑤⑥ D、②④⑤⑥
12、最近有人用一种称为“超酸”的化合物H(CB11H6Cl6)和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]—。这个反应看起来很陌生,但反应类型上却可以跟下列一个化学反应相似,你认为该反应是
A、Mg +2HCl==MgCl2 +H2↑ B、NH3 + HCl==NH4Cl
![]()
C、NaOH+HCl==NaCl +H2O D、H2O+CH3COOH H3O++CH3COO—
13、下列各组中的离子能在同一溶液中大量共存,用足量盐酸酸化后,溶液仍然澄清透明且颜色无变化的是
A.K+ Ba2+ HCO![]() NO
NO![]() B.Na+ K+ OH-
AlO
B.Na+ K+ OH-
AlO![]()
C.Na+ Ca2+ Cl- HPO42— D.Mg2+ NO![]() SO
SO![]() Fe2+
Fe2+
14、对下列实验现象的推测中,正确的是
A.将HBr通入酸性KMnO4溶液中溶液颜色由紫红色变成橙红色
B.![]() 溶液中存在平衡:
溶液中存在平衡:![]()
![]()
![]() ,加入少量稀盐酸后溶液浅绿色会加深
,加入少量稀盐酸后溶液浅绿色会加深
C.![]() 有漂白性,将
有漂白性,将![]() 通入石蕊试液中,溶液将先变红后褪色
通入石蕊试液中,溶液将先变红后褪色
D.硫酸铝溶液显酸性,次氯酸钠溶液显碱性,这两种溶液混合后会产生白色沉淀
15、纳米材料是由纳米粒子(粒子直径 1 nm ~100nm)所组成的材料,它具有奇特的光、热、声、电、磁、力学和化学活泼性等性质。下列分散系中不含纳米粒子的是
A.血液 B.无尘无雾含水蒸气的空气
C.豆浆 D.在沸水中滴入几滴FeCl3溶液
16.“类推”是一种常用的学习方法,但有时会产生错误的结论,下列类推结论中正确的是
A.ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点
顺序也是:AsH3>PH3>NH3
B.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化
物的稳定性顺序也是:HCl>H2S>PH3
C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子
D.干冰(CO2)是分子晶体,则SiO2也是分子晶体
17、有一瓶无色气体,可能含有H2S、CO2、HBr、HCl、SO2中的一种或几种。向其中加入过量氯水,得到无色透明溶液,把溶液分成两份;向其中加入盐酸化的BaCl2溶液,出现白色沉淀;向另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀。则下列结论正确的是 A.原气体中肯定有SO2 B.原气体中肯定没有H2S和HBr
C.原气体中肯定有SO2和HCl D.原气体中肯定没有CO2
18、下列离子方程式正确的是
A.Fe2O3溶于过量的氢碘酸中 Fe2O3+6H+=2Fe3++3H2O
B.次氯酸钠溶液中通入过量的二氧化硫 ClO-+SO2+H2O====HSO3-+HClO
C. FeBr2溶液中加入过量的氯水 2Fe2++4Br-+3Cl2====2Br2+2Fe3++6Cl-
D.澄清的石灰水中加入过量的NaHCO3溶液:
Ca2++2OH-+2HCO3-====CaCO3↓+2H2O+CO32-
19、向下列分散系中滴加稀硫酸,先生成沉淀继而沉淀又溶解的是
A、Fe(OH)3胶体 B、H2SiO3胶体 C、NaAlO2溶液 D、Ba(HCO3)2溶液
第Ⅱ卷(非选择题 共83分)
20.(10分)(1)配制0.1mol·L一1的NaOH溶液时,下列操作会导致实际浓度偏高的是
A.使用的砝码部分生锈 B.定容时俯视容量瓶的刻度线
C.选用的容量瓶内残留有少量蒸馏水
D.定容、摇匀后,发现液面低于刻度线,再加水至刻度线
(2)按要求填空:
①用已准确称量的1.06gNa2C03固体配制0.100mol·L一1Na2C03溶液100ml,所需要的仪器为 。
②除去NaNO3固体中混有少量的KNO3,所进行的实验操作依次为 、蒸发、结晶、 。
③除去KCl溶液中的SO42—,依次加入的试剂为(填溶质的化学式) 。
21、(10分)甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银四种溶液中的一种。将它们两两混合后,观察到的现象是:①甲与乙或丙混合都产生沉淀。②丙与乙或丁混合也产生沉淀;③丁与乙混合产生无色气体。回答下面的问题:
(1)写出乙与丁反应的离子方程式: 。
(2)这中种溶液分别是甲 乙 丙 丁 。(填化学式)
22、(10分)为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了如下图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
|
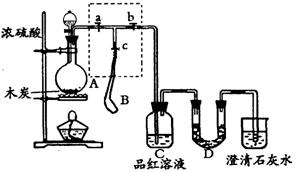
请回答下列问题:
(1)实验前欲检查装置A的气密性,可以采取的操作是
。
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是 (用操作编号填写);
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(3)实验时,装置C中的现象为 。
(4)当D中产生 (多选不得分)现象时,可以说明使E中澄清石灰水变浑的是CO2,而不是SO2;
A.进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
B.脱脂棉上蓝色均变浅 C.脱脂棉上蓝色褪去
则装置D的作用为 。
23、(13分)某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2—、S2―、SO32—、CO32—、SO42—。现取该溶液进行有关实验,实验结果如下图所示:

请回答下列问题:
(1)沉淀甲是_______生成沉淀甲的离子方程式为_____________________。
(2)沉淀乙是_______由溶液甲生成沉淀乙的离子方程式为__________________。
(3)沉淀丙是_______如何用一化学实验来确定其成分?____________________。
(4)气体甲的成分有哪几种可能?_____________________。
(5)综合上述信息,可以肯定存在的离子有_____________________。
24、(12分)阅读下列材料:
过氧化氢(H2O2)又称双氧水,常温下它是一种液体,它难电离,且易分解。作为一种经典化工产品,工业上早在100多年前便开始生产。随着社会需求的增长,尤其是生态环境保护的需要,过氧化氢近年来更受到人们的青睐,并称其为绿色氧化剂。为了贮存、运输、使用的方便,工业上采用“醇析法”将其转化成固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。“醇析法”的生产工艺过程如下:
在0℃~5℃下,往饱和的Na2CO3溶液中,先加入H2O2和稳定剂(MgCl2和Na2SiO3),经充分反应后,再加入异丙醇,过滤分离,即得过碳酸钠晶体。
根据上述材料,回答下列问题:
(1)依据你已有的知识,写出H2O2的结构式_______________________。
(2)你认为H2O2被称为绿色氧化剂的主要原因是:_______________________。
(3)我们知道,稀硫酸不与铜反应,但在稀硫酸中加人H2O2后,则可使铜顺利溶解,写出该反应的离子方程式:_________________________________________。
(4)稳定剂能反应生成难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为:
______________________________________________________。
(5)加入异丙醇的作用是____________________________________________。
(6)下列物质不会使过碳酸钠失效的是____________。
A.MnO2 B.H2S C.CH3COOH D.NaHCO3
25、(12分)已知两个羟基同时连在同一碳原子上的结构是不稳定的,它要发生脱水反应:
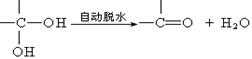
现有分子式为C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生上述一系列反应
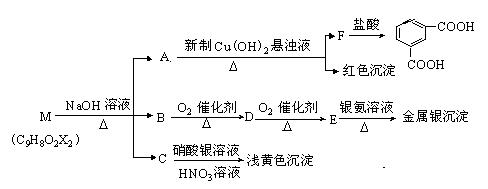
试回答下列问题:
⑴ X为 (填元素 符号);
⑵A中所含的官能团为 ,上述转化中其中属于氧化反应的共有 步(填数字);M与NaOH溶液共热反应的所属类型是 反应。
⑶ M的结构简式为 。
⑷写出下列反应的化学方程:
①B→D ;
②D在一定条件下发生加聚反应: ;
③E和银氨溶液反应的化学方程式为: 。
26、(6分)已知有关物质的氧化性强弱顺序为:浓H2SO4>Fe3+>H+。现将30.0gFe粉(过量)与50.0mL浓H2SO4在加热条件下充分反应,共收集到11.2L(STP)气体(设生成的气体全部逸出),其质量为19.6g。试计算:
(1)浓H2SO4的物质的量浓度
(2)反应后剩余铁粉的质量
27、(10分)治理硝酸工业中的尾气中的氮氧化物(NO、NO2)的化学原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O;NO2+NO+2NaOH=2NaNO2+H2O。
现有标准状况下的a LNO2(其中N2O4的体积分数为20%)、b LNO的混合气体,恰好被200mL一定浓度的NaOH溶液完全吸收。
⑴根据上述条件可知,a : b的值应在 范围中。
⑵设生成的NaNO3的物质的量为n1,NaNO2的物质的量为n2 。
①当产物全部为NaNO2时,求n2的值。
②当产物中兼有NaNO3和NaNO2时,求n1和n2的值。
⑶求上述NaOH溶液的物质的量浓度。
 化学月考试题答题卷
化学月考试题答题卷
|
题号 |
第I卷 | 第II卷 |
总分 | |||||||
| 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | |||
| 分数 |
|
|
|
|
|
|
|
|
|
|
第Ⅰ卷答题卡(把正确答案涂黑)
![文本框: 1、[A][B][C][D]2、[A][B][C][D]3、[A][B][C][D]4、[A][B][C][D]5、[A][B][C][D]
6、[A][B][C][D]7、[A][B][C][D]8、[A][B][C][D]9、[A][B][C][D]
10、[A][B][C][D]11、[A][B][C][D]12、[A][B][C][D]13、[A][B][C][D]14、[A][B][C][D]
15、[A][B][C][D]16、[A][B][C][D]17、[A][B][C][D]18、[A][B][C][D]19、[A][B][C][D]](/attachimg/tkgzhx/jieyanggaosan5923/image031.gif) |
第Ⅱ卷非选择题(共83分)


高三化学月考试题参考答案及评分标准
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 答案 | C | C | A | D | C | B | B | A | A | |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 答案 | C | B | B | AB | AD | B | B | AB | CD | AC |
20、(10分)(1)AB(2分)(2)①100ml容量瓶、烧杯、量筒、玻璃棒、胶头滴管(3分) ②溶解(1分)过滤(1分) ③BaCl2[或Ba(OH)2],K2C03,HCl(3分)
21、(10分)(1)CO32—+2H+
CO2↑+H2O(2分)
(2)甲CaCl2 乙Na2CO3 丙AgNO3 丁HCl(每空2分)
22、(10分)(1)关闭分液漏斗的活塞,打开止水夹a和b,关闭止水夹c,用手捂热(或微热)圆底烧瓶A,若C中有气泡冒出,移开手掌(或热源)后,C处导管内有水上升,则证明A装置的气密性良好。(3分)(2)③①②(2分) (3)品红溶液褪色(2分) (4)A(1分)除去SO2并检验SO2已被除净。(2分)
23、(13分)(1)S(1分);![]() (2分)
(2分)
(2)![]() (1分);
(1分);![]() (2分)
(2分)
(3)![]() 或
或![]() 和
和![]() (1分);在所得沉淀中加入足量稀盐酸,若沉淀不能全部溶解说明其中有
(1分);在所得沉淀中加入足量稀盐酸,若沉淀不能全部溶解说明其中有![]() ,反之则无。(2分)
,反之则无。(2分)
(4)若![]() 与
与![]() 恰好完全反应,气体可能是
恰好完全反应,气体可能是![]() ;若
;若![]() 过量,气体可能是
过量,气体可能是![]() 或
或![]() 混合气体,若
混合气体,若![]() 过量,气体可能是
过量,气体可能是![]() 或
或![]() 和
和![]() 混合气体。(2分)
混合气体。(2分)
(5)![]() 。(2分)
。(2分)
24、(12分,每空2分)(l)H—O—O—H(2)H2O2的还原产物为H2O,反应时不产生污染物(3)Cu+H2O2+2H+=Cu2++2H2O(4)MgCI2+Na2SiO3=MgSiO3↓十2NaCI
(5)降低过碳酸钠的溶解度,有利于晶体析出 (6)D
25、(12分)⑴Br (1分) ⑵醛基(1分);4步(1分);取代(或水解)(1分)
![]()
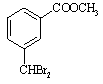 ⑶
(2分)⑷2 CH3OH+O2
2HCHO +2H2O
(2分)
⑶
(2分)⑷2 CH3OH+O2
2HCHO +2H2O
(2分)
![]() ②
(2分)
②
(2分)
![]() ③HCOOH+2Ag(NH3)2OH (NH4)2CO3+2Ag↓+2NH3↑+H2O (2分)
③HCOOH+2Ag(NH3)2OH (NH4)2CO3+2Ag↓+2NH3↑+H2O (2分)
(每个反应式全对各得2分,条件不写扣1分。第⑷②反应中氧化产物写成CO2、H2CO3或NH4HCO3 (HOCOONH4)均可以,只要反应式写对且配平都给分)
26、(6分)(1)c(H2SO4)=(0.60mol+0.20mol)÷0.05L=16.0mol/L
![]() (2)剩余m(Fe)=30.0g-56g/mol×(0.30mol+0.20mol)=2.0g.
(2)剩余m(Fe)=30.0g-56g/mol×(0.30mol+0.20mol)=2.0g.
27、(10分)NO2、N2O4存在平衡2NO2 N2O4 ,随着NO2的消耗,N2O4全部转化为NO2,
⑴V(NO2)=0.8aL V(N2O4)=0.2aL 反应时,V(NO2)总=0.8aL+2×0.2aL=1.2aL
由题意反应原理可知:当 V(NO2)≥V(NO)时,混合气体可被全部吸收。所以,1.2aL/bL≥1, a:b≥5:6 (2分)
⑵①由反应式:NO2+NO+2NaOH===== 2NaNO2+H2O而知:n2=2(NO2)总=2(NO)=2b/22.4 mol (或2.4a/22.4 mol) (2分)
② 2NO2 +2NaOH =NaNO3 + NaNO2+H2O
![]()
![]()
![]() mol
mol
mol
mol
mol
mol
NO2 + NO + 2NaOH= 2NaNO2+H2O。
![]()
![]()
![]() mol
mol
mol
mol
mol
mol
![]() 由上述反应原理及关系可知:n1=
mol (2分) ,
由上述反应原理及关系可知:n1=
mol (2分) ,
![]()
![]()
![]() n2= (
+
) mol=
mol(2分)
n2= (
+
) mol=
mol(2分)
![]() ⑶n(NaOH)=n(NaNO2)+n(NaNO3)=n(NO+NO2总)=
mol
⑶n(NaOH)=n(NaNO2)+n(NaNO3)=n(NO+NO2总)=
mol
![]()
![]() c(NaOH)=
mol/0.2L=
mol/L(2分)
c(NaOH)=
mol/0.2L=
mol/L(2分)