|
2005—2006学年度上学期高三年级联合考试
化学试卷
YCY
 可能用到的相对原子质量:H—1 Al—27 Na—23 Mg—24 O—16 N—14 C—12
可能用到的相对原子质量:H—1 Al—27 Na—23 Mg—24 O—16 N—14 C—12
 Fe—56
Cu—64 P—31
Fe—56
Cu—64 P—31
第Ⅰ卷(选择题,共45分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个正确选项符合题意。)
1.俄罗斯科学家最近合成出第114号元素的一种原子,该原的质量数为289,则该原子的中子数和电子数之差为 ( )
A.61 B.114 C.175 D.289
2.已知热化学方程式:2H2O(g)=2H2(g)+O2(g);△H=+483.6kJ/mol,2H2(g)+O2
(g)=2H2O(l);△H=-571.6kJ/mol,当18g液态水变为气态水时,△H为 ( )
A.△H=-88kJ/mol B.△H=+88kJ/mol
C.△H=-44kJ/mol D.△H=+44kJ/mol
3.在一定浓度BaCl2溶液中通入SO2气体未见产生沉淀,若先通入一种气体,再通入SO2,则有白色沉淀,这种气体不可能是 ( )
A.NH3 B.CO2 C.NO2 D.Cl2
4.有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是 ( )
A.V3>V2>V1 B.V3=V2=V1YCY C.V3>V2=V1 D.V1=V2>V3
5.用NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.23gNa与足量水反应转移电子数为2NA
B.1mol甲基中含有10NA个电子
C.62g白磷中含P—P键为3NA
D.1mol氖气含有的原子数为2NA
6.下列关于实验操作的叙述中正确的是 ( )
A.从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶
B.在中和滴定的实验过程中,目光应注视滴定管中的液面
C.用胶头滴管向试管中滴加液体,一定要将滴管伸入试管中
D.可燃性气体点燃之前必须验纯
7.下列离子方程式正确的是 ( )
A.氨水中通入少量的SO2:NH3·H2O+SO2 NH4++HSO3—
B.CaCO3跟醋酸反应:CaCO3+2H+ Ca2++CO2↑+H2O
C.Cl2通入烧碱溶液:Cl2+2OH— ClO—+Cl—+H2O
D.FeCl3溶液显酸性:Fe3++3H2O Fe(OH)3↓+3H+
8.有8种物质:①甲烷;②苯;③聚乙烯;④甲苯;⑤乙炔;即能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是 ( )
A.③④⑤ B.④⑤ C.只有⑤ D.全部
9.下列说正确的是 ( )
A.NaCl晶体中含有Na+、Cl—,所以NaCl晶体能导电
B.CO2溶于水能导电,所以CO2是电解质
|
D.HCl液体不导电,但溶于水能导电
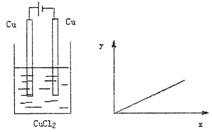
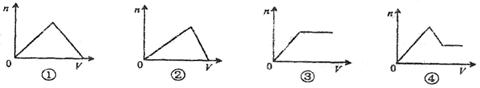
10.按图进行实验,若坐标图x轴表示流入阴极
电子物质的量,则y轴表示的是(YCY)
A.溶液中Cl—的物质的量浓度
B.阴极析出的Cu的物质的量
C.溶液中Cu2+物质的量浓度
D.溶液的pH
二、选择题(本题包括5小题,每小题3分,共15分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
11.已知卤素单质与烷烃在光照条件下发生取代反应,现有一烷烃取代产物的化学式为C2H2ClF3,则其同分异构体有 ( )
A.1种 B.2种 C.3种 D.4种
12.一定量的Fe和Fe2O3混合物投入250ml 2mol/L的HNO3溶液中,反应完全后,无固体剩余,生成1.12L NO气体(标况),再向反应后溶液中加入1mol/L的NaOH溶液,要使铁元素合部沉淀下来,所加NaOH溶液的体积最少是 ( )
A.450ml B.500ml YCY C.400ml D.无法确定
13.在25℃时,用HCl溶液滴定NaOH溶液,以甲基橙作指示剂,当溶液呈橙色时,则( )
A.滴入的HCl溶液不足 B.滴入的HCl溶液过量
C.[H+]·[OH—]=1×10—14 D.HCl和NaOH恰好中和
14.下列各组数据关系中,前者比后者大的是 ( )
A.纯水100℃和25℃时的pH
B.Na2CO3溶液中的HCO3—和OH—数目
C.常温下pH相同的CH3COOK溶液和KOH溶液中由水电离出的OH—离子浓度
D.100mL 0.1mol/L的CH3COOH溶液与10mL 0.1mol/L的CH3COOH溶液的H+数目
15.下列各组离子在溶液中能大量共存的是 ( )
A.Fe3+、Cl—、Na+、SO42—ycy B.Al3+、Na+、HCO3—、NO3—
C.Ag+、Na+、SO42—、NO3— D.AlO2—、CO32—、K+、Na+
第Ⅱ卷(非选择题 共55分)
三、填空题(本题包括16~21题,共34分)
16.(6分)(1)室温下,0.01mol/L的硫酸氢钠溶液的pH为 ,在其中滴入等体积的pH=12的Ba(OH)2溶液后,所发生反京戏的离子方程式为
。
(2)只用一种试剂把Fe、FeO、FeS、CuO、C、MnO2六种黑色粉末鉴别出来,该试剂是
(写名称),MnO2与该试剂反应的化学方程式为 。
17.(5分)已知某溶液中只存在OH—、H+、NH4+、Cl—4种离子,该溶液中各离子浓度的大小关系可能有下列4种情况:
①c(NH4+)>c(Cl-)>c(H+)>c(OH-) ②c(Cl-) > c(NH4+)>c(H+)>c(OH-)
③c(NH4+)>c(Cl-)> c(OH-) > c(H+) ④c(H+)+c(NH4+)= c(OH-)+(Cl-)
请填写下列空白:
(1)若该溶液中只溶解了一种溶质,则该溶质是 ,此时上述关系中,能表示该溶液中4种郭子浓度关系的有 (填序号);
(2)若该溶液是体积相等的稀盐酸和氨水混合而成,且pH=7,则混合前c(HCl)
c(NH3)(填“>”、“=”或“<”)
18.(6分)短周期元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次层电子数的3倍,B是短周期元素中原子半径最大元素。试回答下列问题:
(1)A的元素符号 ;D的原子结构示意图 。
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是 填具体离子符号)
(3)CA2与D元素的单质在水溶液中反应的化学方程式是
![]() 19.(6分)A、B、C三种不同的物质,都含有同一种元素,它们能发生如下转变:
19.(6分)A、B、C三种不同的物质,都含有同一种元素,它们能发生如下转变:
A B C
(1)若A是气体单质,则B可能是(填化学式) 。
(2)若A是固态单质,试列举其晶体类型不同的两例(填化学式) ,向B溶液中通入CO2时,产生沉淀的物质的量随通入CO2的体积的变化关系是 。
|
(3)若A是难溶于水的离子化合物,则A→B反应的离子方程式是 。
|
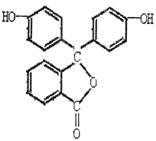
(1)酚酞的化学式为; 。
(2)从结构上酚酞可看做:
A.烯烃 B.芳香族化合物
C.醇类物质 D.酚类物质
E.羧酸类物质 F.酯类物质
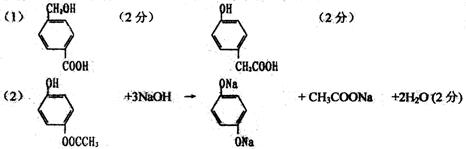
21.(6分)分子式为C8H8O3的芳香族化合物有多种不同的结构,其中A、B、C三种有机物苯环上的一氯取代物均有两种。等物质的量的A、B、C分别与足量的NaOH溶液完全反应时,消耗NaOH的物质的量为1:2:3。
(1)A可发生分子间酯化反应;B遇FeCl3溶液显紫色,其分内含有羧基,则A、B的结构简式分别为A. B.
(2)C可以看为酯类,C与足量的NaOH溶液反应的方程式为
四、实验题(本题共10分)
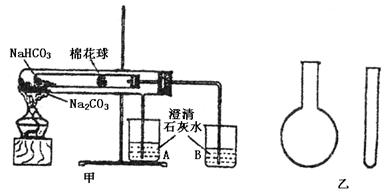
|
实验一:如图甲,小试管内塞有沾有无水硫酸铜粉末的棉花球。
(1)点燃酒精灯后,在棉花球上及烧杯B中能观察到的现象有
(2)整个实验结束时,在操作上需要特别注意的问题是
(3)通过该实验可以得出的结论是
实验二:在氨气的喷泉实验中,将圆底烧瓶集满氨气的操作很麻烦,请设计一个简单的操作方法,只有一支试管(如图乙),选用下列药品:A.氯化铵固体;B.氢氧化钠固体;C.浓氨水;D.浓硫酸,采用“套管法”在圆底烧瓶中集满喷泉实验所用氨气。
(4)制备氨气所用到的试剂为: 。(填序号)
(5)请简述所设计的操作及判定收集满氨气的现象:
五、(本题包括24、25两小题,共11分)
23.(5分)有机物A由C、H、O三种元素组成。现取3gA与4.48LO2(标准状况)在密闭容器中燃烧,生成CO2、CO和H2O(g)。反应后将生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g。求
(1)有机物A中C、H、O三种原子的物质的量之比。
(2)确定该有机物的分子式。
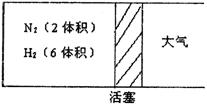
24.(6分)在一定温度下,把2体积N2和6体积H2通入一个带活塞的容积可变的容器中,活塞一端与大气相通(如图),发生如下反应:
|
![]() N2(g)+3H2(g) 2NH3(g);△H<0。
N2(g)+3H2(g) 2NH3(g);△H<0。
若反应达到平衡后,测得混合气体为7体积,据此回答下列问题:
(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后,混合气体中各物质的百分含量仍与上述平衡时完全相同,若a=1,c=2,则b= ,在这些条件下,反应起始时将向 方向进行(填“正”或“逆”)
(2)在上述装置中,若需控制平衡后气体的6.5体积,则可采取的措施是 ,
原因是 。
参考答案及评分标准
一、选择题(每题3分,共30分)
1.A 2.D 3.B 4.C 5.C 6.D 7.C 8.C 9.D 10.B
二、选择题(每题3分,共15分)
11.C 12.A 13.BC 14.CD 15.AD
三、填空题(本题包括16~21小题,共33分)
|
(2)浓盐酸(1分),MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O(2分)
|
18.(1)O(1分), (1分) (2)S2—>O2—>Na+(2分)
(3)SO2+Cl2+2H2O=2HCl+H2SO4(2分)
19.(1)NaClO(1分) (2)Al、Si(分) ③(1分)
(3)Al2O3+2OH— 2AlO2—+H2O(2分)
|
21.
四、实验题
22.(本题共10分)
(1)棉花球变蓝;B中持续出现气泡,溶液变白色浑浊(3分)
(2)防止倒吸(或答:停止加热前,先移出石灰水中导管)(1分)
(3)Na2CO3热稳定性大于NaHCO3,NaHCO3受热分解,有CO2和水生成(2分)
(4)B、C(1分)
(5)倒置烧瓶;在小试管内装入所需药品,迅速将试管伸进烧瓶中,并将试管中靠近烧瓶底;一会儿,将湿润的红色石蕊试纸靠近烧瓶口,若变蓝,则已集满NH3(3分)
五、23.(1)n(C):n(H): n(O)=3: 8: 1(3分) (2)C3H8O(2分)
24.(1)b=3(2分),逆(1分) (2)降温(1分),因为正反应是放热反应,降温使平衡向正反应方向移动。(2分)