化学计算类
1、在100g浓度为18mol/L、密度为ρ(g/cm3)的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入的水的体积为
A 小于100mL B 等于100mL C 大于100mL D 等于100/ρmL
2、在10mL0.01mol/L的纯碱溶液中,不断搅拌并逐滴加入1.2mL 0.05mol/L盐酸,完全反应后在标准状况下生成二氧化碳的体积为
A 1.34mL B 2.240mL C 0.672mL D 0mL
 3、、将标准状况下的a升氯化氢气体溶于100克水中,得到的盐酸的密度为b克/毫升,则该盐酸的物质的量的浓度是
3、、将标准状况下的a升氯化氢气体溶于100克水中,得到的盐酸的密度为b克/毫升,则该盐酸的物质的量的浓度是
A、![]() B、
B、![]()
C、![]() D、
D、![]()
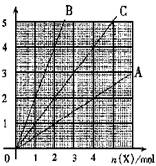
4、右图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量
n(X).纵坐标表示消耗O2的物质的量n(O2),A、B是两种可燃气体,C是A和B的混合气化则C中n(A):n(B)为
A.2:1 B.1:2
C.1:1 D.任意比
5、已知25%氨水的密度为0.91g.cm-3,5%氨水的密度为0.98g·cm-3,若将上述两溶液等体积混合,所得氨水溶液的质量分数是
A. 等于15% B.大于15% C.小于15%
D.无法估算
6、由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同。 则该混合气体中CO2H和CO的体积比为
A29:8:13 B22:1:14 C13:8:29 D26:16:57
7、某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g。若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的溶质质量分数是
A 30% B ![]() ×100% C 26.5% D
×100% C 26.5% D ![]() ×100%
×100%
8、用足量的CO还原32.0 g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60 g沉淀,则该氧化物是
A FeO B Fe2O3 C CuO D Cu2O
9、在100mL含等物质的量的HBr和H2SO3的溶液里通入0.01mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于:
A 0.0075mol•L-1 B 0.008mol•L-1 C 0.075mol•L-1 D 0.08mol•L-1
10、某温度下向100g澄清的饱和石灰水中加入5.6g生石灰,充分反应后恢复到原来的温度。 下列叙述正确的是
A.沉淀物的质量为5.6g B.沉淀物的质量为7.4g
C.饱和石灰水的质量大于98.2g D.饱和石灰水的质量小于98.2g
11、质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水,得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的分子量(相对分子质量)为
A ![]() B
B ![]()
C ![]() D
D ![]()
12、某温度下,甲、乙两个烧杯中各盛有100 g相同浓度的KCl溶液,现将甲烧杯中的溶液蒸发掉35gH2O,析出晶体5g;乙烧杯中的溶液蒸发掉45gH2O,析出晶体10g。则原溶液的质量分数为
A 10% B 15% C 20% D 25%
13、若以ω1和ω2分别表示浓度为a mol·L-1和b mol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)
A 2ω1=ω2 B 2ω2=ω1 C ω2>2ω1 D ω1<ω2<2ω1
14、有等体积、等![]() 的Ba(OH)2、NaOH和
的Ba(OH)2、NaOH和![]() 三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为
三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为![]() ,则三者的大小关系正确的是
,则三者的大小关系正确的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
15、.某温度下,在100克水中加入m克CuSO4或加入n克CuSO4·5H2O,均可使溶液恰好达到饱和,则m与n的关系符合 B
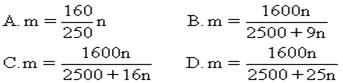
16、已知t℃时,某物质的不饱和溶液a克中含溶质m克,若该溶液蒸发b克水并恢复到t℃时,析出溶质m1克.若原溶液蒸发c克水并恢复到t℃时,则析出溶质m2克.用S表示该物质在t℃时的溶解度,下式中正确的是
(A)S=![]() (B)S=
(B)S= ![]()
(C) S= ![]() (D) S=
(D) S= ![]()
17、将60℃的硫酸铜饱和溶液100克,冷却到20℃,下列说法正确的是
(A)溶液质量不变 (B)溶剂质量发生变化
(C)溶液为饱和溶液,浓度不变 (D)有晶体析出,溶剂质量不变
18、一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6 g,若其中水的质量为10.8 g,则CO的质量是
(A)1.4 g (B)2.2 g (C)4.4 g (D)在2.2 g和4.4 g之间
19、在一定温度下,向足量的饱和Na2CO3溶液中加入1.06 g无水Na2CO3,搅拌后静置,最终所得晶体的质量
A. 等于1.06 g B. 大于1.06 g而小于2.86 g
C. 等于2.86 g D. 大于2.86 g
20、已知某盐在不同温度下的溶解度(见下表):
| T(℃) | 0 | 10 | 20 | 30 | 40 |
| S(g / 100 g水) | 11.5 | 15.1 | 19.4 | 24.4 | 37.6 |
若把质量分数为22%的该盐溶液由60℃逐渐冷却,则开始析出晶体的温度应在
A. 0℃—10℃ B. 10℃—20℃ C. 20℃—30℃ D. 30℃—40℃
21、分别取等质量80℃的甲、乙两种化合物的饱和溶液,降温至20℃后,所析出的甲的质量比乙的大(甲和乙均无结晶水)。下列关于甲、乙溶解度的叙述中肯定正确的是( )
A. 20℃时,乙的溶解度比甲的大 B. 20℃时,甲的溶解度比乙的大
C. 温度对乙的溶解度影响较大 D. 温度对甲的溶解度影响较大
22、甲、乙两种化合物都只含X、Y两种元素,甲、乙中X元素的百分含量分别为30.4%和25.9%.若已知甲的分子式是XY2,则乙的分子式只可能是
(A)XY (B)X2Y (C)X2Y3 (D)X2Y5
23、将a g含NaOH样品溶解在b mL 0.1 mol/L的硫酸中,再加入c mL 0.1 mol/L的氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中NaOH的纯度是(NaOH式量为40)
A.[(b-c)/125a]× 100% B.[(b-2c)/125a]×100%
C.[(b-c)/250a]× 100% D.[(8b-8c)/a]× 100%