高三化学 物质结构 元素周期律单元检测
一、选择题:
1. 三氯化氮分子中每个原子最外层均达到8电子稳定结构,且氮与氯的共用电子对偏向于氮原子。则下列关于三氯化氮的叙述正确的是
A.NCl3跟水反应的产物为NH3和HClO
B.NCl3跟水反应生成NH4Cl、O2和Cl2
C.在NCl3分子中N为+3价,跟水发生水解反应的产物是HNO2和HCl
![]()
D.NCl3的电子式应表示为
2.下列化合物中阳离子半径元素与阴离子半径比值最小的是 ( )
A.NaF B.MgI2 C.BaI2 D.KBr
3.某元素最高价含氧酸的化学式为HxROy,则气态氢化物的化学式 ( )
A.H8+x-2yR B.H8(2x+y)R C.H2x+8+yR D.RH8+x-2y
4.把元素R的气态氢化物HnR在高温下分解为固态物质和H2,若在同温同压下,气体产物的体积与原气体体积相等,并且分解前后两种气体质量之比为17∶1,则下列叙述正确的是 ( )
A.R的离子各电子层电子数分别为2、8、8
B.R的最高价氧化物的水化物酸性比磷酸强
C.R的最高价氧化物中含氧50%
D.R的含钠化合物(NanR)不能与氯水发生置换反应
5.四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是 ( )
A.a-b=n-m B.原子序数a>b>c>d
C.元素非金属性Z>R D.最高价氧化物对应水化物碱性X>Y
6.两种短周期元素组成的化合物中,原子个数比为1∶2或2∶1,若两种元素的原子序数分别为p和q,则下列关系正确的是 ( )
①p+q=15; ②p=q+5; ③p=q-5; ④p+q=22;
A.①④ B.①③④ C.①②③④ D.①②④
7、在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是( )
A.XY3晶体一定是离子晶体
B.若Y的原子序数为n,X的原子序数一定是n±4
C.X和Y可属于同一周期,也可属于两个不同周期
D.X和Y一定不属于同一主族
8、周期表中有些元素有“对角线相似”现象(即周期表中处于对角线位置的两元素性质相似),如Li、Mg;Be、Al;B、Si等两两性质相似。现用熔融LiCl电解的方法可得锂和氯气。若用已潮解的LiCl加热蒸干并强热至熔融,再用惰性电极电解,结果得到金属锂和一种无色无味的气体。据此,下列说法正确的是
A.电解前LiCl在加热时已发生水解
B.电解时产生的无色气体是O2
C.无色气体为电解生成的锂与水反应放出的H2
D.无色气体是阳极放出的Cl2与水作用生成的O2
9. A、B、C、D均为短周期的4种元素,当A、B两种元素的两个原子分别得到两个电子形成稳定结构时A放出的能量大于B放出的能量,当C、D两元素的原子分别失去1个电子形成稳定结构时D吸收的能量大于C吸收的能量。若A、B、C、D4种元素间分别形成化合物时属于离子化合物可能性最大的是 ( )
A.C2A B.C2B C.D2A D.D2B
10.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为 ( )
A.分子晶体 B.原子晶体
C.离子晶体 D.金属晶体
11.有![]() 、Ym+、Zp— 3种短周期元素的离子,它们各自带有的电荷数p<n<m=3,且Zp—的电子层数比
、Ym+、Zp— 3种短周期元素的离子,它们各自带有的电荷数p<n<m=3,且Zp—的电子层数比![]() 、Ym+多1,比较X、Y、Z及其化合物,则下列说法正确的是 ( )
、Ym+多1,比较X、Y、Z及其化合物,则下列说法正确的是 ( )
A.它们的最高价氧化物的水化物之中,Y(OH)m是一种两性氢氧化物,其碱性比X(OH)n弱,其酸性也比Z的最高价含氧酸弱
B.原子半径Z>X>Y
C.单质的熔点依Z、Y、X递增
D.气态氢化物稳定性依X、Y、Z增强
12.下列各组顺序正确的是 ( )
A、微粒半径大小:S2- > Cl- > F- > Na+ > Al3+
B、热稳定性大小:SiH4 > PH3 > NH3 > H2O > HF
C、熔点高低:石英 > 食盐 > 干冰 > 碘片
D、等物质的量浓度溶液,酸性强弱顺序:HCl > HCOOH > CH3COOH > H2CO3
13、R为短周期元素,其原子所具有的电子层数为最外层电子数的1/2,它可能形成的含氧酸根离子有:① R2O42-,② RO42-,③ R2O32-,④ RO32-,下列判断正确的是 ( )
A.当它形成①时,可能形成②③
B.当它形成②时,可以形成③④
C.当它形成①时,也能形成④
D.当它形成②时,可以形成①
14.食盐晶体如图1所示。在晶体中,· 表示Na+,o 表示Cl-。已知食盐的密度为r g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是( )
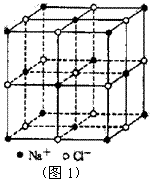 A.
A. ![]() cm
B.
cm
B. ![]() cm
cm
C. ![]() cm
D.
cm
D. ![]() cm
cm
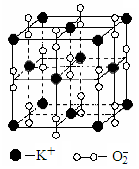 15.高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是
( )
15.高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是
( )
A.超氧化钾的化学式为KO2,每晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧原子与-2价氧原子的数目比为3:1
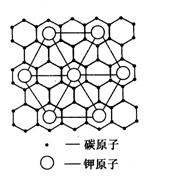 16.石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳谈原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见下图,则x值为( )
16.石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳谈原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见下图,则x值为( )
A . 8 B. 12 C.24 D.60
二、填空题:
17.有A、B、C、D四种元素,A元素的气态氢化物分子式为RH4,其中R的质量分数为75%,该元素核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88.9%,核内质子数和中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。
(1)A元素的一种无色透明的单质,名称叫______,其晶体类型是______。
(2)B的氢化物的电子式为______,属______分子。(极性或非极性)
(3)A和B形成化合物的分子空间构型为______,属______分子,其晶体类型是______。俗名______。
 (4)C元素位于周期表中第______周期______族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列(用分子式表示)______。
(4)C元素位于周期表中第______周期______族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列(用分子式表示)______。
(5)C和D的化合物溶于水后滴入过量KOH,现象是______,离子方程式______。
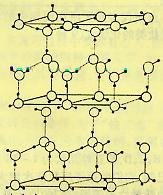
18.水分子间存在一种叫“氢键”的作用(介于范德瓦尔斯力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键相互连接成庞大的分子晶体一次,其结构示意图如图所示
⑴1mol冰中有 mol“氢键”
⑵水分子可电离生成两种含有相同电子数的微粒,其电离方程式为: 。
⑶在冰的结构中,每个水分子与相邻的4个水分子以氢键相连接。在冰晶体中除氢键外,还存在范德瓦尔斯力(11kJ•mol—1)。已知冰的升华热是51 kJ•mol—1,则冰晶体中氢键的能量是 kJ•mol—1
⑷用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系是 ,其判断依据是______________________________________________________________
________________________________________________________________________。
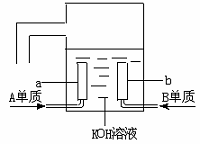 19、A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体;两种是固体。回答:
19、A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体;两种是固体。回答:
(1)写出由B、C二元素所形成的原子个数比为1∶1的化合物的电子式__________,其晶体中存在的化学键有____________________(填化学键名称)。
(2)写出两种均由A、B、C、D四种元素组成的化合物的化学式__________、__________。
这两种化合物的水溶液发生反应的离子方程式为_________ ______。
(3)用A元素的单质与B元素的单质可制成新型的化学电源,已在宇宙飞船中使用。其构造如下图所示。两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。则a是____极,电极反应式为____________________,b是_____极,电极反应式为__________ __________。
| 甲 | ||
|
|
20、甲、乙、丙、丁为四种短周期元素,在周期表中,甲与乙、丙、丁在周期表中位置关系如右图所示(乙、丙、丁未标出)。已知四种元素的原子序数之和为40,丁的原子序数与乙、丙原子序数之和相等,四种元素原子的最外层电子数之和为24。
(1)甲元素在周期表中的位置是第 周期第 族。
(2)这四种元素可按原子个数比1∶2两两化合,
形成的化合物的化学式有 、 、 。(写出三种即可)
(3)乙、丙两元素可形成AB3型化合物,其电子式可表示为 。
21、已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | I | e |
| 原子核数 | 单核 | 四核 | 双核 |
| 粒子的电荷数 | 一个单位正电荷 | 0 | 一个单位负电荷 |
物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:请填写下列空白:
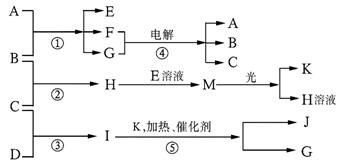
(1)写出下列物质的化学式:
A、 D、 F、____________________
J、 K、
(2)写出下列反应的离子方程式:
①H+E(溶液)→M 。
②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为 。
22.(8分)X、Y、Z为短周期元素的单质,U、V为它们的化合物,这些物质之间的关系如右图所示,其中反应条件和某些产物已经略去:
(1)如果X、Y的组成元素是同主族的,写出反应I的化学反应方程式:
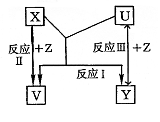 ①若已知V是水:
。
①若已知V是水:
。
②若已知U、V均为氧化物: 。
(2)如果X、Y的组成元素不同主族时,按下列要求回答问题。
①若X组成元素是地壳中含量最多的金属元素时,则X、Y、Z的化学式是:X为 ;Y为 ;Z为 。
②若Y组成元素在自然界中形成的化合物种类最多时,则V、U的化学式是:V为 ;U为 。
③若Z是通常情况下密度最小的物质,则反应I的化学反应方程式: 。
23、有X、Y、Z三种元素,已知①它们是周期表中前20号元素,X、Y和Z均不在同一周期;②它们可以组成化合物XY2、YZ2和XZ;③X的阳离子和Z的阴离子的核外电子排布相同;④Y很难形成简单的阳离子或阴离子。请填写下列空白:
(1)X___________;Y___________;Z___________。(填元素符号)。
(2)XY2与水反应的化学方程式是_______________________________。
(3)在XY2、YZ2和XZ中,含有非极性键的是___________________,含有极性键的非极性分子是____________________(填化学式)。
24.(6分)有A、B、C、D四种单质,在一定条件下,B可以和A、C、D化合生成甲、乙、丙,C和D化合生成化合物丁,丁遇空气变成红棕色气体。已知甲,乙,丙的每个分子中都含有10个电子,并且甲,乙,丙,丁有如下列框图所示的转化关系,请填写下列空白:
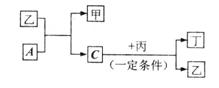 |
(1)单质B的化学式 。
(2)单质A跟化合物乙反应的化学方程式 。
(3)根据化合物丙、丁中D元素的化合价,判断丙和丁能否在一定条件下发生化学反应生成D单质。若认为能反应,写出反应的化学方程式,若认为不能反应,简要说明理由 。
25.(9分)已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号
X 、Y 、Z 、W 。
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件) 。E分子的空间构型为 ,电子式为 。E在催化剂存在的条件下可用于还原汽车尾气中的 ,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为 。
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量NaOH溶液反应的离子方程式 。
(5)将9g单质Y在足量W单质中燃烧,所得气体通入lL lmol·L-1NaOH溶液中,完全吸收后,溶液中的各离子浓度由大到小的顺序是 。
物质结构 元素周期律单元检测
答案
1.A 2.B 3.AD 4.AB 5.BC 6.C 7.C 8.AB 9.A 10.B 11.A 12.AD 13.BC
14.B 15.AD 16.A
![]() 17.
(1)金刚石;原子晶体
17.
(1)金刚石;原子晶体
(3)直线型分子;非极性;分子晶体;干冰
(4)3;ⅢA;HClO4>H2CO3>H3AlO3
(5)先有白色沉淀,滴入过量KOH时白色沉淀消失。
Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2—+2H2O
![]() 18.(1)
2 (2) H2O + H2O H3O+
+ OH-
18.(1)
2 (2) H2O + H2O H3O+
+ OH-
(3) 20 (4) x > z > y 水中含氢键,故沸点最高,硒化氢比硫化氢相对分子质量大,分子间作用力大,故硒化氢沸点高。
19、(1)![]() 离子键、非极性键
离子键、非极性键
(2)NaHSO3 NaHSO4 H++HSO![]() ====SO2↑+ H2O
====SO2↑+ H2O
(3)负 2H2 +4OH— —4e-====4H2O
正 O2 +2H2O +4e-====4OH-
20、(1)二、ⅥA

|
|
|
|
|
|
|
21、(1)B.Cl2 J.NO(2) ①H+ +ClO-= HClO②NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-
NH4++OH-
(3)2HCl(g)=H2(g)+Cl2(g);△H= +184.6 kJ·mol-1
22.(1)①![]() ②
②![]()
(2)①![]() ②
②![]() ③
③![]()
23、(1)Ca
C S (2)CaC2+ 2H2O![]() Ca(OH)2+HC≡CH↑ (3)CaC2 CS2
Ca(OH)2+HC≡CH↑ (3)CaC2 CS2
24.(1)H2 (2)2F2+2H2O=4HF+O2
(3)能 4NH3+6NO=5N2+6H2O
解析:因为A、B、C、D均为单质,而B可以和A、C、D化合生成甲、乙、丙、说明甲、乙、丙都是含有两种元素的化合物,又因为甲、乙、丙都含有10个电子,所以可能是HF、H2O、NH3、CH4中的三种,而B一定是H2,从图示看出乙+A=甲+C该反应一定是置换反应,在F2、O2、N2、O2中能与HF、H2O、NH3、CH4彼此反应且属于置换反应的只有2F2+2H2O=4HF+O2,所以乙为H2O,A为F2,甲为HF,C为O2,又因为丁遇空气变成红棕色气体,则丁一定是NO,丙为NH3。
![]()
![]() 25.(1)H C N O (2)3H2+N2
2NH3 三角锥形
NO,NO2
25.(1)H C N O (2)3H2+N2
2NH3 三角锥形
NO,NO2
![]() (3)NH4++H2ONH3·H2O+H+ (4)NH4++HCO3-+2OH-=NH3↑+ +2H2O
(3)NH4++H2ONH3·H2O+H+ (4)NH4++HCO3-+2OH-=NH3↑+ +2H2O
(5)c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
提示:(1)X元素原子形成的离子就是一个质子,则X为氢元素。Y原子的最外层电子数是内层电子数的2倍,Y只能是碳元素。周期表中相邻元素的单质常温下均为无色气体的只有氮气和氧气。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,则该盐为NH4HO3,由于NH4+水解,溶液呈酸性,所以长期使用NH4NO3会使土壤酸化。
(4)这四种元素组成的原子个数比为5∶1∶1∶3的化合物是NH4HCO3,它与足量NaOH反应生成NH3和Na2CO3,即NH4HCO3+2NaOHNH3↑+Na2CO3+2H2O。
![]() (5)9g碳为
生成的CO2也是0.75mol,n(NaOH)=1L×1mol·L-1=1mol。
(5)9g碳为
生成的CO2也是0.75mol,n(NaOH)=1L×1mol·L-1=1mol。
没完全吸收后,溶液中Na2CO3、HaHCO3物质的量分别为x、y,由Na原子守恒、C原子守恒可得
所以完全吸收后的溶液中含0.25mol Na2CO3和0.5mol NaHCO3的混合物,溶液中离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)