高三化学 限时测试 2月16号
1、通常把原子数和电子数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中错误的是
A、B3N3H6分子各原子均在同一平面上 B、CH4和NH4+是等电子体,均为正四面体结构
C、H3O+和NH4+是等电子体;均为三角锥形 D、B3N3H6分子中不存在双键;
2、在某稀溶液中含4molKNO3和2.5molH2SO4,向其中加入1.5molFe粉,充分反应后产生的气体在标况下的体积为
A、36L B、28L C、22.4L D、11.2L
3、设NA为阿佛加德罗常数,下列叙述中正确的是
A、在标况下,完全燃烧2.24L辛烷可生成CO2分子数为0.8NA;
B、常温常压下,30克乙酸与30克葡萄糖含有的氧原子数都是NA;
C、1mol-OH所含的电子数为17NA;
D、1L1mol/L的硫酸铵溶液中铵根离子数会小于2NA
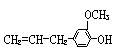 4、有机物丁香油酚的结构简式为:
4、有机物丁香油酚的结构简式为:
,其可能具有的性质是:①能发生加成反应;②能使酸性高锰酸钾溶液褪色;③能发生显色反应;④能发生取代反应;⑤能发生中和反应;⑥能发生消去反应。
A、全部 B、仅能发生①②③④ C、除⑥外都能 D、除④⑥外都能
5、某溶液含有较多的Na2SO4和少量的Fe2 (SO4)3若用该溶液制取芒硝,可供选择的操作有:
①加适量H2SO4溶液,②加金属Na,③结晶,④加过量NaOH溶液,⑤加强热脱结晶水,⑥过滤.正确的操作步骤是
(A)②⑥③ (B)④⑥①③ (C)④⑥③⑤ (D)②⑥①③⑤
6、下列各组离子,在强碱性溶液中可以大量共存的是
A、I-、AlO2-、Cl-、S2- B、Na+、K+、NH4+、Ba2+
C、Br-、S2-、Cl-、CO32- D、SO32-、NO3-、SO42-、HCO3
7、在室温下等体积的酸和碱的溶液,混合后pH值一定小于7的是
(A)pH=3的硝酸跟pH=11的氢氧化钾溶液 (B)pH=3的盐酸跟pH=11的氨水
(C)pH=3的硫酸跟pH=11的氢氧化钠溶液 (D)pH=3的醋酸跟pH=11的氢氧化钡溶液
8、两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是
A、CH4 C2H4 B、CH4 C3H6 C、C2H4 C3H4 D、C2H2 C3H6
9、将等体积的0.4mol/LCH3COONa和0.2mol/LHNO3溶液混合,则混合液中下列关系正确的是:A、[Na+]>[CH3COO-]>[NO3-]>[H+]>[OH-]
B、[Na+]>[CH3COO-]>[H+]>[NO3-]>[OH-]
C、将混合液中加水稀释过程中,[H+]/[Na+]的比值变大;
D、将混合液中加水稀释1010倍以后,溶液PH接近10,[NO3-]=10-11mol/L。
10、将40mL 1.5mol/L的CuSO4溶液与30ml 3mol/L的NaOH溶液混合,生成浅蓝色的沉淀,假如溶液中[Cu2+]或[OH—]都已变得很小,可忽略,则生成沉淀的组成可表示为
(A)Cu(OH)2 (B)CuSO4•Cu(OH)2 (C)CuSO4•2Cu(OH)2 (D)CuSO4•3Cu(OH)2
11、下列离子方程式书写正确的是
(A)碳酸氢钙溶液中加入过量的氢氧化钠溶液: HCO3—- + OH-— ═ CO32-— + H2O
(B)氯化铁溶液中通入硫化氢气体: 2Fe3+ + S2-— ═ 2Fe2+ + S↓
(C)次氯酸钙溶液中通入过量二氧化碳: Ca2+ +2ClO -+ H2O +CO2 ═CaCO3↓+ 2HClO
(D)氯化亚铁溶液中加入硝酸: 3Fe2+ + 4H+ + NO3-— ═ 3Fe3+ + 2H2O + NO↑
12、1molX气体和amolY气体在体积可变的密闭容器中发生如下反应:X(g) + aY(g) bZ(g)反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
(A)a=1,b=1 (B)a=2,b=1 (C)a=2,b=2 (D)a=3,b=2
13、分子式与苯丙氨酸相同,且同时符合下列两个条件:①有带有两个取代基的苯环;②有一个硝基直接连在苯环上的异构体的数目是
A、3 B、5 C、6 D、10
14、300K时,2SO2(g)
+ O2(g) ![]() 2SO3(g) ;△H=-196.6 kJ/mol。在一体积固定的密闭容器中通入2mol SO2、1mol O2,平衡时放出热量Q1 , SO2的转化率α1;在另一体积相同的密闭容器中通入 1mol SO2、0.5mol
O2,平衡时放出热量Q2
, SO2的转化率α2 。下列结论正确的是
2SO3(g) ;△H=-196.6 kJ/mol。在一体积固定的密闭容器中通入2mol SO2、1mol O2,平衡时放出热量Q1 , SO2的转化率α1;在另一体积相同的密闭容器中通入 1mol SO2、0.5mol
O2,平衡时放出热量Q2
, SO2的转化率α2 。下列结论正确的是
A.Q2< Q1<2Q2 α1<α2 B.Q1=196.6 kJ α1>α2
C.Q2 <98.3 kJ α1=α2 D.Q1>2Q2 α1>α2
15、质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为
A.等于2c mol/L B.大于2c mol/L
C.小于2c mol/L D.在c mol/L∽2c mol/L之间
16、已知S、Cr两元素的最高价相同,试分析下列微粒中氧原子间可能存在非极性键的是
A.S2O32- B.S2O82- C.Cr2O72- D.CrO5
17、下列物质属于离子化合物,且阴、阳离子数目之比为1∶1的是
A.HCl B.H2O2 C.Na2O2 D.NH 4NO3
18、①HCO3--、OH-- ②H2PO4--、PO43-- ③HCO3--、AlO2-- ④Fe3+、SCN--
⑤ClO--、SO32-- 上述各组离子中不能在水溶液中大量共存的是
A.①② B.①③④
C.①④⑤ D.全部
19、.有A、B、C三种短周期元素,已知A元素原子最外层电子数等于其电子层数,B元素原子最外层电子数是其电子层数的2倍,C元素原子最外层电子数是其电子层数的3倍。这三种元素形成的化合物不可能是
A.A3BC4 B.A2(BC4)3 C.A2B2C2 D.A2BC4
20、X+ 、Y+ 、Z2-是三种主族元素形成的离子,X+ 与Z2-具有相同的电子层结构,Y和Z处于同一周期。下列说法正确的是
A.原子序数:X>Y>Z
B.原子半径:Y>Z>X
C.离子半径:Z2->X+>Y+
D.在不同条件下,X、Z两元素可能形成X2Z2和X 2Z两种化合物
1、粗碘中通常含ICl和IBr,称为卤素互化物,其性质和卤素相似,都是较强的氧化剂,而且受热时ICl和IBr皆可象I2一样升华。在粗碘中加入下选项中一种物质后,再进行升华可制得精碘,应加入的物质是
A.H2O B.Zn C.KI D. KCl
2、把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是
A.氧气 B.二氧化氮 C.二氧化氮和氧气 D.二氧化氮和一氧化氮