2005年高三化学选择题精编专项训练----元素化合物
1、能产生氯气的反应是
(A)加热次氯酸钙和亚硫酸盐的混合物
(B)在KMnO4中加入NaCl和浓H2SO4共热
(C)CaCl2加H2SO4并加热 (D)在浓HCl中加入浓H2SO4并加热
2、下列关于卤素的叙述中正确的是
①卤素的钾盐中,最易被氧化的氟化钾:②溴中溶有少量氯气,可以用加入溴
化钠再用汽油萃取的方法提纯;③溴化银具有感光性,碘化银不具感光性;④某溶液与淀粉碘化钾溶液反应出现蓝色,则证明该溶液是氯水或溴水;⑤氟气跟氯化钠水溶液反应,一定有HF和O2生成;⑥氯气跟水反应时,水既不是氧化剂也不是还原剂。
(A)①③⑤ (B)②④⑥ (C)②⑤⑥ (D)①③④
3、溴化碘(IBr)的化学性质类似卤素单质,它同水反应的化学方程式为
IBr + H2O == HBr + HIO,下列有关IBr的叙述不正确的是
(A)IBr是共价化合物 (B)在很多反应中,IBr是强氧化剂
(C)IBr跟水反应时既不是氧化剂,也不是还原剂
(D)IBr跟NaOH稀溶液反应生成NaI、NaBrO和水
4、在密闭容器中盛有H2、O2、Cl2的混合气体,通过电火花点燃,三种气体正好完全反应,冷却至室温后,所得液体产物质量分数为25.26%,则容器中原有H2、O2、Cl2的分子个数比是
(A)6:3:1 (B)9:6:1 (C)13:6:1 (D)10:6:1
5、能与硝酸银溶液反应产生沉淀的物质是
(A)CCl4 (B)KClO3 (C)漂白粉 (D)氯苯
6、(CN)2、(SCN)2、(OCN)2称“拟卤素”,与卤素单质性质相似,且其阴离子性质也相似,有2Fe+3(SCN)2==2Fe(SCN)3;2Fe+3Cl2==2FeCl3。 又知拟卤素与氢形成的酸一般比氢卤酸弱。下列化学方程式中错误的是 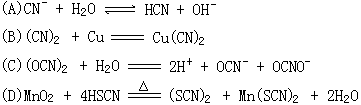
7、已知BrCl能发生下列反应(M为+n价金属元素)nBrCl + 2M == MCln + MBrn,
BrCl + H2O == HCl + HBrO 以下推论不正确的是
(A)BrCl具有和卤素单质相似的化学性质
(B)BrCl与M反应时,BrCl只做氧化剂
(C)将BrCl与Na溶液反应生成NaCl和NaBrO两种盐
(D)将BrCl跟FeSO4溶液反应,溶液会变成无色
8、电导仪测得液态BrF3具有微弱的导电性。表示BrF3(液)中有阴、阳离子X和Y存在。X和Y也存在于BrF2SbF4、KBrF4、(BrF2)SnF6等化合物中,则X、Y的化
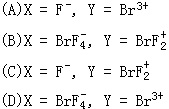 学式分别为
学式分别为
9、标准状况下112LH2S燃烧用掉氧气100.8L(标准状况),燃烧后把产生的物质冷却到原来状况,剩余气体体积缩小为原混合气体体积的21.05%,则充分燃烧的H2S气体占H2S总体积的
(A)40% (B)32% (C)74% (D)80%
10、向50mL18mol/LH2SO4溶液中加入足量的铜片并加热。充分反应后,被还原的H2SO4的物质的量是
(A)<0.45mol (B)=0.45mol (C)在0.45mol和0.90mol之间 (D)0.90mol
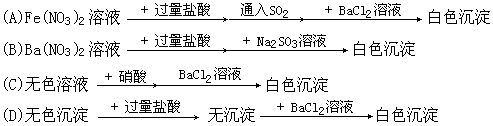
11、下列过程中,最终的白色沉淀不一定是BaSO4的是
12、把硫和强碱(如NaOH)加热至沸,反应后,硫转化为S2-和SO32-,则反应的S和生成的S2-、SO32-的物质的量之比为
(A)2:1:1 (B)3:2:1 (C)3:1:2 (D)4:1:3
13、将等体积的硫化钠溶液与亚硫酸钠溶液混合,并加入适量的硫酸,有浅黄色沉淀生成,微热,无酸性气体产生,这表明原硫化钠溶液与亚硫酸钠的物质的 量之比为
(A)3:2 (B)1:2 (C)2:1 (D)2:3
14、将nmolK2SO3和mmolNa2S溶于水,用稀硫酸酸化后,若生成物分别是①SO2和S,
②S和H2S,③只有S。则n与m之比值从(Ⅰ)1:2,(Ⅱ)大于1:2,
(Ⅲ)小于1:2中选出符合上述情况的组合是
(A)(Ⅰ)(Ⅱ)(Ⅲ) (B)(Ⅱ)(Ⅲ)(Ⅰ)
(C)(Ⅲ)(Ⅱ)(Ⅰ) (D)(Ⅱ)(Ⅰ)(Ⅲ)
15、在常温常压下,将aLSO2和bLH2S混合,当反应后气体体积是反应前气体体积的1/4时,则a与b之比是 ①1:1, ②1:2, ③1:3, ④2:1
(A)① (B)②③ (C)③④ (D)①③
16、常温下,向20L真空容器内通入amolH2S和bmolSO2(a和b都是正整数,且a≤5,b≤5),反应完全后,容器内气体可能达到的最大密度约是
(A)14.4g/L (B)5.1g/L (C)8g/L (D)24.5g/L
17、测得某黄铜矿(CuFeS2)中含硫20%,该矿中含铜的质量分数为
(A)10% (B)20% (C)30% (D)40%
18、将XmolNa2SO3和YmolNa2S完全溶于水后,再加入稀H2SO4酸化,这时可能有三种情况:①生成物只有S、Na2SO4和水 ②生成物为SO2、S,Na2SO4和水 ③生成物为H2S、S、Na2SO4和水 则X:Y的值也应有三种情况即:a)>0.5, b)<0.5, c)=0,5。按上述①②③情 况的顺序选出X:Y的比值排列顺序正确的是
(A)c,a,b (B)a,c,b (C)a,b,c (D)c,b,a
19、在空气中放置一段时间的KOH固体,经分析知其中含水a%,含K2CO3b%,其余为KOH。取此样品mg溶于100mL浓度为1mol/L的H2SO4中,所得溶液中剩余的H2SO4需加ngKOH才能完全中和,然后将溶液蒸干,可得固体物质(不含结晶水)的质量为
(A)3.1(m+n)g (B)14.2g (C)17.4g (D)20.6g
20、将绿矾晶体加强热,除生成水蒸气以外,还发生如下反应:
![]() ,如将生成的混合气体通入氯化钡溶液,应发生的现象有
,如将生成的混合气体通入氯化钡溶液,应发生的现象有
(A)一定产生BaSO4沉淀 (B)一定产生BaSO3沉淀
(C)一定有SO2逸出 (D)一定有SO3逸出
21、用向下排气法在容积为VmL的集气瓶中收集氨气。由于空气未排完,最后瓶内气体的平均相对分子质量为19。将此盛满气体的集气瓶倒置于水中,瓶内水面上升到一定高度后即停止上升。则在同温同压下,瓶内剩余气体的体积为
(A)V/4mL (B)1/5mL (C)V/6mL (D)无法判断
22、把3体积的NO2气体,依次通过下列3个分别装有①NaHCO3饱和溶液,②浓H2SO4,③Na2O2的装置后,用排水法把残留气体收集到集气瓶中,集气瓶内气体应是(同温同压下测定)
(A)1体积NO (B)2体积NO2和0.5体积O2 (C)2体积O2 (D)0.25体积O2
23、在标况下,将O2与NO按3:4体积比充满一干燥烧瓶,将烧瓶倒置于水中,瓶中液面逐渐上升后,最终烧瓶内溶液的物质的量浓度最接近于
(A)0.45mol/L (B)0.036mol/L (C)0.026mol/L (D)0.030mol/L
24、碘化膦(PH4I)是一种白色晶体。根据你所学的知识,判断下列关于碘化膦的描述错误的是
(A)它是离子晶体,稳定,高温也不分解 (B)它的水溶液显酸性
(C)能跟强碱反应放出气体PH3 (D)该物质中含有共价键,配位键和离子键
25、化合物M溶于水,加入少量硝酸银溶液有白色沉淀。如果先在M的水溶液中加入一定量的苛性钠溶液,再加入少量硝酸银溶液,若无沉淀生成,则M可能是
(A)氯化铵 (B)食盐 (C)氯化钙 (D)氯化镁
26、在1L/mol/L的氯水中
(A)含有1molNH3分子 (B)含有NH3和NH4+之和为1mol
(C)含NH3·H2O1mol (D)含NH3、NH3·H2O、NH4+之和为1mol
27、在一定温度下,向足量的饱和Na2CO3溶液中加入1.06g无水Na2CO3搅拌后静置,最终得到晶体的质量是
(A)等于1.06g (B)大于1.06g而小于2.86g (C)等于2.86g (D)大于2.86g
28、ag纯净的碳酸钠和ag碳酸钠与碳酸氢钠的混合物相比,下列各种情况的描述正确的是 (A)分别和盐酸反应时,混合物的耗酸量大
(B)分别和足量盐酸反应时,混合物放出的CO2多
(C)分别配制成等体积溶液,混合物的pH值大
(D)分别配制成等体积溶液,混合物的Na+的物质的量大
29、在下列各物质溶液中通入CO2看不到明显现象的一组是
(A)Na2SiO3与C6H5ONa (B)CaCl2与NaOH溶液混合
(C)CaCl2与Ba(NO3)2 (D)NaAlO2与Ca(ClO)2
30、在120℃时,将2LH2O、1LN2、1LCO、1LO2和2LCO2组成的混合气体依次缓缓通过过量的热铜粉,过量过氧化钠和过量炽热木炭粉的三个反应管。经充分反应后,恢复到原来温度和压强。其气体体积是
(A)2.5L (B)3.5L (C)5L (D)6L
31、在一定体积的密闭容器中充入CO2后,压强为P,若再向其中投入足量的Na2O2,充分反应后,容器内的压强等于
(A)P (B)2P (C)1/2P (D)3/2P
32、把6.2gNa2O溶于93.8g水中;把4.6g金属钠溶于95.6g水中;把7.8gNa2O2溶于93.8g水中;把8gNaOH溶于92g水中,得到的溶液的质量分数
(A)都是8% (B)分别为8%、8%、7%、10%
(C)都是9% (D)分别为6%、7%、8%、10%
33、将4.34gNa、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672mL混合气体,将该混合气体通过放电,恰好完全反应,则它们的物质的量之比为
(A)1:1:1 (B)1:1:2 (C)1:2:1 (D)4:3:2
34、有甲、乙、丙3瓶等体积、等物质的量浓度的硫酸,若将甲用水稀释,在乙中加入少量的氯化钡溶液,丙不变。然后用等浓度的NaOH溶液滴定,至恰好完全反应时,所需NaOH溶液的体积是
(A)丙>乙>甲 (B)甲=丙>乙 (C)乙>丙>甲 (D)甲=乙=丙
35、将xmolNa2O和Na2O2分别投入过量的yg水中,得质量分数分别为a%和b%的两种溶液,则a和b的关系为
(A)a=b (B)a>b (C)a < b (D)78a=62b
36、某固体物质跟浓H2SO4共热可生成一种酸性气体。若把氨水加到此物质的溶液中,先生成白色沉淀,继续加氨水沉淀消失,则此固体物质可能是
(A)MgCl2 (B)AlCl3 (C)AgNO3 (D)Cu(NO3)2
37、为了除去氯化镁酸性溶液种的Fe3+离子,可在加热搅拌条件下加入物质M后过滤,在滤液中加入适量盐酸即可,则物质M可选
(A)NaOH (B)NH3·H2O (C)Na2CO3 (D)MgCO3
38、用下列方法除去含有Ca2+、Mg2+、HCO3-、Cl-的硬水,所得的水含离子浓度最小的方法是
(A)蒸馏 (B)加热煮沸 (C)用石灰纯碱法 (D)用离子交换法
39、下列两种溶液反应,将第一种溶液滴入第二种溶液与将第二种溶液滴入第一种溶液时,发生的反应不完全相同的是
①AlCl3与NaOH ②AgNO3与NH3·H2O ③Na2PO4与H2SO4
④NaAlO2与盐酸 ⑤苯酚钠与盐酸
(A)①②⑤ (B)①②③④ (C)②③⑤ (D)全部
40、检验钢质设备完好性的方法之一是:在被怀疑有裂纹处涂上6mol/L盐酸,过一段时间若观察到有粗线裂纹,表示该处原先确有看不见的细裂纹,产生粗线裂纹的主要原因是
(A)原裂纹处有碳积存 (B)裂纹处表面积很大,反应快
(C)裂纹处的尘埃起催化作用
(D)裂纹处有氧化铁积存,并与盐酸作用生成可溶性氯化物
答案
1.B 2.C 3.D 4.C 5.C 6.C 7.D 8.B 9.A
10.A 11.C 12.B 13.C 14.B 15.D 16.A 17.B 18.A
19.C 20.A 21.C 22.D 23.C 24.A 25.A 26.D 27.D
28.B 29.C 30.D 31.C 32.A 33.D 34.D 35.A 36.C
37.D 38.A 39.B 40.D