重庆市重点中学2006年高三第二轮复习化学
综合检测
本试卷分第Ⅰ卷(选择题)和第II卷(非选择题)两部分。共150分。考试时间120分钟。可能用到的原子量:H 1 C 12 O16 N 14 Na 23 Ba 137 Mg 24 S 32
第Ⅰ卷(选择题 共72分)
一、选择题 (本题包括8小题,每小题4分,共32分,每小题只有一个选项符合题意)
1.《京都议定书》于2005年2月16日正式生效,从控制温室气体排放的角度来看,下列工
业受影响最小的是: ( )
A.硫酸工业 B.陶瓷工业 C.钢铁工业 D.水泥工业
2.有些地区水井中的水刚从井中抽出时是清澈透明的,但烧开后发现产生了红褐色的不溶
物。某中学研究性学习小组对这种现象进行了分析:向刚抽出的井水中加入硫氰化钾溶
液,无明显现象,向产生不溶物的水中加入盐酸,结果不溶物溶解,再向其中加入硫氰
化钾溶液,出现血红色,则下列说法不正确的是: ( )
A. 该井水中肯定有Fe3+ B. 该井水中肯定有Fe2+
C. 红褐色不溶物是Fe(OH)3 D. 红褐色不溶物是由于氧化和水解产生的
3.下列各组溶液在只有水和试管的情况下,达不到鉴别目的的是 ( )
A.溴乙烷、乙醇、乙酸乙酯三种液体
B.Na2O2、CaCl2、CuSO4、硫磺四种固体
C.CaCO3、NaHSO4、CaC2、Mg(OH)2四种固体
D.NaCl、Na2SO4、AlCl3、Mg3N2四种固体
4.下列关于浓硫酸的叙述正确的是 ( ) A.浓硫酸具有脱水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体
D.浓硫酸在常温下不与铁、铝等金属反应,因而可用铁制容器装浓硫酸
5.下列实验操作错误的是 ( )
A.除去苯中的少量苯酚:加入NaOH溶液
B.欲除去乙酸乙酯中的少量乙酸,加入乙醇和浓硫酸,使乙酸转化为乙酸乙酯,振荡、
静置分层分液,除去水层
C.除去CO2中的少量SO2:通过盛有足量饱和NaHCO3溶液的洗气瓶
D.提取溶解在水中的少量碘:加入CCl4振荡、静置分层后取出有机层再分离
6.已知KH和H2O反应生成H2和KOH,反应中生成1molH2,KH ( )
A.失去1mol电子 B.得到1mol电子 C.失去2mol电子 D.没有电子得失
7.氢叠氮酸(HN3)与醋酸酸性相近。氢叠氮酸盐(NaN3)稳定,但撞击发生爆炸生成氮气。下列有关氢叠氮酸及其盐的说法中不正确的是 ( )
A.固体HN3属于分子晶体 B.HN3的水溶液呈弱酸性
C.NaN3的水溶液呈弱酸性 D.NaN3可用于汽车防撞保护气囊
8.X、Y、Z三种非金属,原子最外层电子数相等,等物质的量的单质X2、Y2、Z2分别与足量钠反应时,反应热为△![]() >△
>△![]() >△
>△![]() ,下列判断正确的是 ( )
,下列判断正确的是 ( )
A.原子半径:X<Y<Z
B.气态氢化物的稳定性:HnX< HnY< HnZ
C.气态氢化物的沸点:HnX> HnY> HnZ
D.最高价氧化物对应的水化物的酸性可能为:HZO4<HYO4<HXO4
二、选择题 (本题包括10小题,每小题4分,共40分,每小题有一个或两个选项符合题意)
9.下列说法不正确的是 ( )
A.相同温度下,pH =4醋酸溶液与0.01mol·L-1盐酸溶液中,c(H+)之比小于1∶100
B.常温下,向氯化铵溶液中加入适量氨水,使混合液pH=7,混合液中c(NH4+)=c(Cl-)
C.0.1mol·L-1Na2CO3溶液中,c(Na+)=2c (CO32-) +c(HCO3-) +c(H2CO3)
D.常温下,pH=13的溶液中,NO3-、 AlO2-、 SO42- 、K+可以大量共存
10.将质量为w1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1 L。向溶液中逐滴加入浓度为a mol/L的HCl溶液,先有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2 L。将溶液蒸干灼烧得固体w2g。下列关系式中正确的是 ( )
A.
35.5a V2 =w2-w1
B. ![]() ×16=w2-w1
×16=w2-w1
C. n(Na)+3n(Al)= ![]() D.
a V2 =
D.
a V2 =![]() ×2
×2
11.有关物质的能量关系如图所示,下列热化学方程式正确的是: ( )
 A. A(g) +2B(g) =3C(g); △H=a a>0
A. A(g) +2B(g) =3C(g); △H=a a>0
B. 3C(g) =A(g) +2B(g); △H=a a<0 E
C. A(g) +2B(g) =3C(l); △H=a a<0
D. 3C(l) = A(g) +2B(g) ;△H=a a<0
12.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是 ( )
A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+
2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
13.设阿伏加德常数为NA。则下列说法正确的是 ( )
A. 常温常压下,11.2L甲烷中含有的氢原子数为2NA
B. 标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA
14.下列除去杂质的实验方法正确的是 ( )
A.除去CO中少量O2:通过灼热的Cu网后再收集气体
B.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
C.除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤
D.除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置
15.已知某溶液中存在较多的H+、SO42—、NO3—,则该溶液中还可能大量存在的离子组是
( )
A.Al3+、Mg2+、Cl— B.CH3C00—、Ba2+、Br—
C.Mg2+、Cl—、I— D.Na+、NH4+、Cl—
16.下列离子方程式,正确的是 ( )
A.SO2气体通入Ca(ClO)2溶液中:H2O+SO2+Ca2++2ClO-=CaSO3↓+2HClO
B.室温时向NaHSO4 溶液中逐滴加入Ba(OH)2溶液到中性:
2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
C.向100mL、1mol·L-1的FeI2溶液中通入标准状况下的Cl22.24L 2Fe2++Cl2=2Fe3++2Cl-
![]() D.用铂作电极电解MgCl2溶液: 2Cl-+2H2O H2↑+Cl2↑+2OH-
D.用铂作电极电解MgCl2溶液: 2Cl-+2H2O H2↑+Cl2↑+2OH-
17.阴离子Xn-含有N个中子,X的质量数为A, 则Wg X元素的气态氢化物中含有质子的物质的量为(单位mol): ( )
A.A(n-N)/W B.A(n-N)/(W+A)
C.A(W+n)/(W+N) D. W(A-N+n)/(A+n)
18.已知甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入2mol SO2、1mol O2,初始时两容器的温度体积相同。一段时间后反应达到平衡,为使两容器中的SO2在平衡混合物的物质的量分数相同,下列措施中可行的是 ( )
A.向甲容器中充入一定量的氦气 B.向乙容器中充入一定量的SO3气体
C.升高乙容器的温度 D.增大甲容器的压强
第Ⅱ卷(非选择题,共78分)
三、本题包括2小题,共22分
19.(6分)在常温、常压下,注射器甲中装有NO2气体,
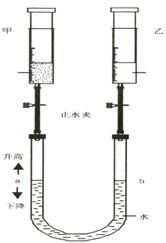 注射器乙中装有同体积的空气(如图所示,夹持仪器
注射器乙中装有同体积的空气(如图所示,夹持仪器
均已略去)。
(1)常温下,打开两个止水夹后,同时向外拉动两注
射器的活塞,且拉动的距离相同,将会看到U型
管中液面a (升高、下降、
不变),试解释这一现象 (二
氧化氮不与水接触)。
(2)如将注射器甲中的气体换成NH3,仍在常温下,
打开两个止水夹后,同时向里推动两注射器的
活塞,且推动的距离相同,将会看到U型管中
液面a (升高、下降、不变),
试解释这一现象 ______ ______。
20.(16分)Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足(写出两点)。
__________________________________________________________________________
。
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
 |
(1)甲装置常常浸在70~80℃的水浴中,目的是_______________________________。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热
状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结
束。
①乙醇的催化氧化反应是_________反应(填“放热”或“吸热”),该反应的化学方程
式为________________________________________。
②控制鼓气速度的方法是_____________________________,若鼓气速度过快则会
_________________________,若鼓气速度过慢则会________________________。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填
戊装置中导管代号):乙接______、______接丙;若产物不用水吸收而是直接冷却,
应将试管丁浸在_________中。
四、本题包括2小题,共18分
21.(6分)下图表示的反应关系中,部分产物被略去,已知1mol白色固体粉末X完全分解后,恢复到室温,生成白色固体A,无色液体B,无色气体C各1mol,E、X、G的焰色反应均为黄色。
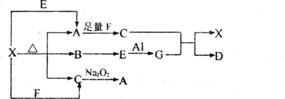
请回答下列问题:
(1)写出下列物质的化学式:X: G: D:
(2)写出G与C反应的化学方程式
(3)写出X+E→A的离子方程式
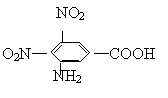
![]() 22.(12分)2005年11月13日13时40分左右吉林石化双苯厂发生爆炸,导致100多吨苯、苯胺(
)、硝基苯流入松花江,造成松花江水被污染。
22.(12分)2005年11月13日13时40分左右吉林石化双苯厂发生爆炸,导致100多吨苯、苯胺(
)、硝基苯流入松花江,造成松花江水被污染。
(1)苯在浓硫酸的作用下,50-60℃时可与硝酸发生硝化反应制得硝基苯,写出化学反应方程式:
苯与浓硫酸在70℃-80℃时可发生磺化反应生成苯磺酸,该反应属于:
A.取代反应 B.加成反应 C.消去反应
(2)为了提高硝基苯和产率,应选择的加热方式是
(3)甲苯也可以发生硝化反应制TNT,写出一个与TNT为同分异构体且含有羧基的有机物的结构简式
五、本题包括2小题,共18分
23.(9分)将1molBr2(g)和2molH2置于2L某闭容器中,于一定温度下发生反应Br2(g)+H2(g) ![]() 2HBr(g); △H<O并达平衡,HBr的体积分数α(HBr)随时间变化如图曲线Ⅱ所示:
2HBr(g); △H<O并达平衡,HBr的体积分数α(HBr)随时间变化如图曲线Ⅱ所示:
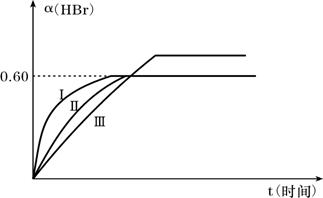 |
①达平衡时,Br2(g)的转化率为
②若改变反应条件,使Ⅱ曲线变成Ⅰ曲线的条件可能是 ,使Ⅱ曲线变成Ⅲ曲线的条件可能是 。
A.恒容条件下升高温度 B.恒容条件下降低温度
C.恒温条件下缩小反应容器体积 D.恒温恒容时充入Ar
E.恒温恒容条件下,加入适当正催化剂
F.恒温条件下,扩大反应容器体积
③若保持温度不变,在另一相同的2L密闭容器中加入amol Br2(g),bmol H2和cmol HBr(a.b.c均大于0)发生反应达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是 。
24.(9分)去年是俄国化学家马科尼可夫(V. V. Markovnikov,1838-1904)逝世100周年。马科尼可夫因提出不对称烯烃的加成规则(Markovnikov Rule)而著称于世。
已知:①CH3CH2Br+NaCN![]() CH3CH2CN+NaBr
CH3CH2CN+NaBr
②CH3CH2CN![]() CH3CH2COOH
CH3CH2COOH
③CH3CH2COOH![]() CH3CHBrCOOH
CH3CHBrCOOH
有下列有机物之间的相互转化:
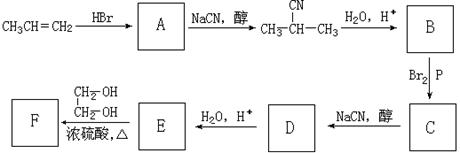
回答下列问题:
(1)指出下列有机反应的类型: B→C ;
(2)下出下列有机反应的化学方程式:
C→D ,
E→F(F为高分子化合物时) ;
(3)F可以有多种结构。写出下列情况下F的结构简式:
①分子式为C7H12O5 ;
②分子内含有一个七元环 ;
(4)上述那一步反应遵循不对称烯烃的加成规则 。
六、本题包括2小题,共20分
|
(1)A的相对分子质量为________。
(2)若测得混合气体中仅含两种常见
元素(不考虑同位素),A、B都
是无机物时,化学式分别为________、
________,A、B都是有机物时,化学
式分别为________、________。
(3)某混合气由A、B等体积混合而成,只含CHO三种元素,将其与适量氧气混合,引燃后反应物均无剩余,将产物依次通过足量浓![]() (减少的体积恰好等于消耗氧气的体积)、足量碱石灰(体积减半),又知通过浓
(减少的体积恰好等于消耗氧气的体积)、足量碱石灰(体积减半),又知通过浓![]() 与通过碱石灰所减少的气体体积之比为5∶2。气体体积均在105℃和1.01×
与通过碱石灰所减少的气体体积之比为5∶2。气体体积均在105℃和1.01×![]() Pa条件下测定,通过计算确定混合气体的组成。
Pa条件下测定,通过计算确定混合气体的组成。
26.(8分)2.80g铁与100ml稀硝酸混合后充分反应,产生气体为NO,反应后铁、硝酸均无剩余。向反应后的溶液中加入100ml 0.2mol/L的碘化钾溶液,恰好将溶液中的Fe3+全部还原,求原硝酸溶液的物质的量浓度。
参考答案
一、二 选择题(本题包括18小题,每小题4分,共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | A | A | D | A | B | A | C | B | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | AC | D | C | C | C | D | AD | B | D | AB |
三、本题包括2小题,共22分
19.(6分)每小题3分
(1)下降;根据勒沙特利原理,甲针筒中2NO2![]() N2O4向左移动,甲针筒中气体的物质的量增加,气压大于乙针筒中气压。
N2O4向左移动,甲针筒中气体的物质的量增加,气压大于乙针筒中气压。
(2)上升;氨气溶于水,使压强降低
20.(16分)Ⅰ.操作麻烦、乙醇转化率低(其它合理答案均可)(2分)
Ⅱ.(1)使产生乙醇蒸气的速率加快(2分)
(2)①放热(2分) 2CH3CH2OH+O2![]()
![]() 2CH3CHO+H2O(2分)
2CH3CHO+H2O(2分)
②控制甲中单位时间内的气泡数 带走过多热量,难以保证反应所需温度 反应放热太少,不能达到反应所需温度(4分)
(3)b a(2分) 冰水(2分)
四、本题包括2小题,共18分
21.(6分)(1)X:NaHC03 G:NaAlO2 D:Al(OH)3 (3分)
(2)NaAlO2+C02+2H20=NaHCO3+Al(OH)3↓ (2分)
(3)HCO3-+0H一=CO32-+H20 (1分)
![]()
![]() 22.(12分)(1) +HO-NO2
22.(12分)(1) +HO-NO2 ![]() +
H2O
+
H2O
A (4分)
 (2)水浴加热 (4分)
(2)水浴加热 (4分)
(3)
(4分)其他正确答案也给分
五、本题包括2小题,共18分
23.(9分)①90%(2分) ②CE,B(4分) ③C=2b-4a (3分)
[解析]①设Br2(g)转化率为x
![]() H2(g)+Br2(g) 22HBr(g) (等体积反应)
H2(g)+Br2(g) 22HBr(g) (等体积反应)
1×x 2x
2x=3×60%
x=90%
②Ⅰ与Ⅱ比,含量不变,即平衡不移动,但平衡时间缩短,即速度加快了,C、E符合;Ⅲ与Ⅱ比,含量虽提高,但达平衡时间变长,即速度减慢,B符合
③属于等效平衡问题
C mol HI相当于I2:![]() mol
H2:
mol
H2:![]() mol
mol
则I2有:![]() mol
H2:
mol
H2:![]() mol
mol
据气体体积不变的可逆反应达到等效平衡的特点,有
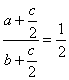 即2b-4a=c
即2b-4a=c
24.答案
(1)取代反应 (1分)
(2) ![]() (1分)
(1分)
 (2分)
(2分)
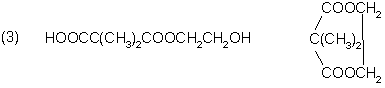 (各2分)
(各2分)
(4)生成A的反应 (1分)
六、本题包括2小题,共20分
25.(12分)答案:(1)44(2分) (2)![]() NO C3H8 C2H6(每空2分,共8分)
NO C3H8 C2H6(每空2分,共8分)
(3)![]() 和
和![]() (甲醛)或
(甲醛)或![]() (乙醛)和
(乙醛)和![]() (2分)
(2分)
解析:根据图象建立方程组,得出A、B分子量分别为44和30,然后利用分子量加上题设的新条件进行求解。第三问难度较大,根据题意,等体积混合可以得出混合气体平均相对分子质量为37;经浓H2SO4、碱石灰吸收后剩余气体应为CO,水蒸气和![]() 体积比为5∶2;产物中
体积比为5∶2;产物中![]() 和CO物质的量相等,设混合气体的平均组成为
和CO物质的量相等,设混合气体的平均组成为![]() ,则有:
,则有:
![]()
![]()
![]()
![]() =
=![]()
联立方程解得:x=2 y=5 z=0.5
则混合气体的平均组成为:![]()
结合A、B的相对分子质量为44和30可推得此混合气体可能为:
![]() 和
和![]() (甲醛)或
(甲醛)或![]() (乙醛)和
(乙醛)和![]()
26.(8分)答案:c(HNO3)= 1.6 mol/L
解析:n[Fe(NO3)3]=n(I-)=0.100L×0.2mol/L=0.020mol
n[Fe(NO3)2]=n(Fe)-n[Fe(NO3)3]=![]() -0.020mol=0.030mol
-0.020mol=0.030mol
根据电子转移守衡
n[Fe(NO3)3]×3+n[Fe(NO3)2]×2=n(NO)×3
0.020mol×3+0.030mol×2=n(NO)×3
n(NO)=0.040mol
根据氮元素守衡
n(HNO3)=n(NO)+n[Fe(NO3)3]×3+[Fe(NO3)2]×2
0.040mol+0.020mol×3+0.030mol×2
=0.16mol
C(HNO3)= ![]()