1、Se是人体必需微量元素,下列有关![]() Se和
Se和![]() Se的说法正确的是
Se的说法正确的是
A、![]() Se和
Se和![]() Se互为同素异形体
B、
Se互为同素异形体
B、![]() Se和
Se和![]() Se互为同位素
Se互为同位素
C、![]() Se和
Se和![]() Se分别含有44和46个质子 D、
Se分别含有44和46个质子 D、 ![]() Se和
Se和![]() Se都含有34个中子
Se都含有34个中子
2、近期,北京大学的两位教授率先发现人体心肺血管中存在微量硫化氢,它对调节心血管功能具有重要作用。下列叙述正确的是
A、硫化氢分子很稳定,受热难分解
B、硫化氢分子中所有原子的最外电子层都达到8电子结构
C、将硫化氢通入溴水,溴水褪色
D、硫化氢是电解质,其电离方程式是H2S=2H++S2-
3、NA为阿伏加德罗常数,下列说法正确的是
A、10g甲烷所含有的电子数目为10NA
B、常温常压下,4g氦气所含有的中子数目为4NA
C、标准状况下,22.4L单质溴所含有的原子数目为2NA
D、电解食盐水若产生2g氢气,则转移的电子数目为2NA
4、下列反应过程中,同时有离子键,极性共价键和非极性共价键的断裂和形成的反应是
A、NH4ClNH3↑+ HCl↑
B、NH3+CO2+H2O=NH4HCO3
C、2NaOH+Cl2=NaCl+NaClO+H2O
D、2Na2O2+2CO2=2Na2 CO3+O2
5、下列反应离子方程式正确的是
A、向氯化铝溶液中加入过量氢氧化钠溶液:Al3+ + 4OH-=
AlO2- + 2H2O
B、向苯酚钠溶液中通入二氧化碳:CO2 + H2O + 2C6H5O-→
2C6H5OH + CO32-
C、向小苏打溶液中加入醋酸溶液:HCO3- + H+=CO2↑+
H2O
D、向溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br - + 2Cl2=Fe3+
+Br2 + 4Cl -
6、下列各组物质仅用蒸馏水不能鉴别出的是
A、苯、酒精、硝基苯
B、食盐、烧碱、硝酸铵
C、蔗糖、硫酸铜粉末、碳酸钙粉末 D、氧化铜、二氧化猛、活性炭
7、在25℃101 kPa下,白磷(化学式为P4)、红磷(化学式为P)、燃烧的热化学方程式分别为:P4(s)+5O2(g)= P4O10(s);△H = -3093.2 kJ/mol 4P(s)+5O2(g)= P4O10(s);△H = -2954.0 kJ/mol 由此判断,下列说法正确的是
A、由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
B、由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低
C、由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
D、由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低
8、下列有关pH变化的判断中,正确的是
A 随着温度的升高,碳酸钠溶液的pH减小
B 随着温度的升高,纯水的pH增大
C 新氯水制经光照一段时间后,pH减小
D 氢氧化钠溶液久置于空气中,pH增大
9、常温下,向一定浓度的氨水中逐滴加入盐酸,在此过程中,下列说法正确的是
A、当pH>7时,c(Cl—)>c(NH4+)>c(OH—) >c(H+)
B、当pH=7时,c(NH4+)>c(Cl—)>c(H+)=c(OH—)
C、当pH<7时,c(NH4+)>c(Cl—)>c(H+)>c(OH—)
D、当氨水与盐酸恰好完全反应时,c(Cl—)>c(NH4+)>c(H+)>c(OH—)
10、下列各组离子一定能大量共存的是
A、含有大量Fe3+的溶液中:NH4+、Na+、CI-、SCN-
B、在强碱溶液中:Na+、K+、AlO2-、CO32-
C、在c(H+)=10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D、在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
11、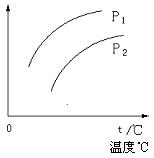 在容积一定的密闭容器中发生可逆反应A(g)+2B(g)
在容积一定的密闭容器中发生可逆反应A(g)+2B(g) ![]() 2C(g),△H>0;平衡移动关系如图所示。下列说法正确的是
2C(g),△H>0;平衡移动关系如图所示。下列说法正确的是
A、P1< P2,纵坐标指A的质量分数
B、P1> P2,纵坐标指C的质量分数
C、P1<P2,纵坐标指A的转化率
D、P1< P2,纵坐标指混合气体的平均摩尔质量
12、下列说法中正确的是
A 最外层有2个电子的原子都是金属原子
B 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C 非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
D 最外层有5个电子的原子都是非金属原子
13、下列液体中,不会出现丁达尔现象的分散系是:①鸡蛋清溶液
②水 ③淀粉溶液 ④蔗糖溶液
⑤Fe(OH)3溶液 ⑥肥皂水
A.②④
B.③④ C.②④⑥
D.④
14、R2O8n-在一定条件下可以把Mn2+氧化为MnO4-,若反应后R2O8n-离子变为RO42-,又知
反应中氧化剂与还原剂的物质的量之比为5:2,则n的值为
A.1
B.2
C.3
D.4
15、相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是
A、弱酸溶液产生较多的氢气 B、强酸溶液产生较多的氢气
C、两者产生等量的氢气 D、无法比较两者产生氢气的量
16、一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) ![]() 3C(g),若反应开始时充入2mol A和2mol
B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2mol A和2mol
B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A、2mol
C B、2mol A、1mol
B和1mol He(不参加反应)
C、1mol B和1mol C
D、2mol A、3mol B和3mol
C
17、在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A、1∶9 B、1∶1 C、1∶2 D、1∶4
18、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B、充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O
C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D、放电时正极附近溶液的碱性增强
19、金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B 电解过程中,阳极质量的减少与阴极质量的增加相等
C 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D 电解后,电解槽底部的阳极泥中只有Cu和Pt
20、X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是
。
(2)Z2Y2与X2Y反应的化学方程式是 。
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ) 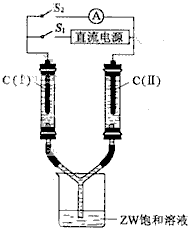 为多孔石墨电极。
为多孔石墨电极。
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)的电极名称是 (填写正极或负极);
C(II)的电极反应式是
。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是
。
21、A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
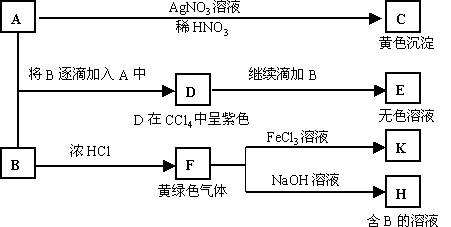
请回答:
(1)写出A、B和C的化学式:A
,B
,C
。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
,
。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
(4)写出由F→H的化学方程式:
。
22、研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应Na2SO3(固)+H2SO4(浓)= Na2SO4 + SO2↑+ H2O,制备SO2气体。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
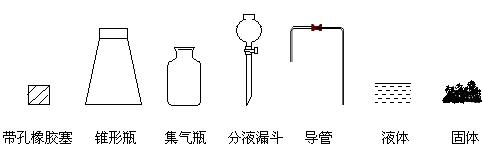
②实验过程中,使用分液漏斗滴加浓硫酸的操作是_____________________________。
(2)将SO2气体分别通入下列溶液中:
①品红溶液,现象是_______________________________________________________;
②溴水溶液,现象是_______________________________________________________;
③硫化钠溶液,现象是_____________________________________________________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
①原因_____________________;验证方法__________________________。
②原因_____________________;验证方法__________________________。
③原因_____________________;验证方法__________________________。
23、将1L含有0.4mol
CuSO4和0.2mol NaCl的水溶液用惰性电极电解一段时间后,在一个电极上得到0.3mol Cu,另一电极上析出气体(在标准状况下)的体积是多少?此时溶液的pH值是多少?
1、B
2、C
3、D
4、D
5、A
6、D
7、D
8、C
9、D
10、B
11、B
12、A
13、A
14、B
15、A
16、A、B
17、D
18、C
19、D
20、(1)Na2O
(2)2Na2O2+2H2O=4NaOH+O2↑ (3)负极
Cl2+2e-=2Cl- (4)Cu+H2O2+2H+=Cu2++2H2O
21、(1)NaI
NaClO AgI (2)2I-+ClO-+H2O=I2+Cl-+OH- I2+5ClO—+2OH—=2IO3-+5Cl-+H2O
(3)Fe3++SO32-+2H2O=Fe2-+SO42-+4H+ (4)Cl2+2NaOH=NaClO+NaCl+H2O
22、(1)①如图配置 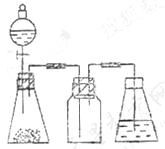
②打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加。
(2)①溶液褪色
②溶液褪色
③有浅黄色沉淀(或溶液变浑浊)
(3)①Na2SO3 变质 取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2 ,溶液有白色沉淀生成,则证明该NaSO3 固体变质
②不是浓硫酸 用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸
23、[解题思路]惰性电极时,依据阴、阳离子放电顺序书写电极反应,阳极:先2C1--2e=Cl2↑,后4OH--4e=O2↑+2H2O。在阳极附近,因OH-放电而促进了水的电离平衡右移,溶液酸性明显增强。由电子守恒关系: C12 ~ Cu, 另析出0.2mol Cu,2Cu
~ O2 ~ 4H+。
0.1mol ![]() 0.1mol
0.2mol
0.1mol
0.2mol ![]() 0.1mol
0.4mol 故V(气体)=V(Cl2)十V(O2)=2.24L十2.24L=4.48L。 电解后c(H+)≈
0.1mol
0.4mol 故V(气体)=V(Cl2)十V(O2)=2.24L十2.24L=4.48L。 电解后c(H+)≈ ![]() =0.4mol/L, pH=-lg c(H+)=1-2lg2。
=0.4mol/L, pH=-lg c(H+)=1-2lg2。