广东省惠
| |
化 学 试 题 2005.10.29
相对原子质量:C: 12 N:14 O:16 Al:27 Fe : 56 Zn : 65
Na:23 S:32 Cl:35.5 Ba : 137 Cu: 64 Mn;55
第一部分 选择题 (共67分)
一、选择题(每小题3分,共27分,每小题只有一个选项符合题意)
1.某学生用化学知识解决生活中的问题,下列家庭小实验不合理的是
A.用食醋除去暖水瓶中的薄层水垢
B.用米汤检验食盐中是否含碘酸钾(KIO3)
C.用纯碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物
2. 以下实验事实中能证明某无色透明液体是纯水的是
A.测得该液体pH = 7
B.电解该液体得到同条件的氢气和氧气的体积比为2 :1
C.向其中投入金属钠,钠于液面上迅速游动,产生气体并发出吱吱声
D.在1.01×105 Pa压强下测得该液体的沸点为100℃
3. 同温同压下,对于等体积的一氧化氮(14N18O)和一氧化碳(13C18O)气体,下列说法正确的是:
A.含相同的分子数和原子数 B.含相同的分子数和电子数
C.含相同的质子和中子数 D.所含分子数和质量均不相同
4. 25 ℃时,相同物质的量浓度的下列溶液中,水的电离程度排列顺序正确的是
①NaCl ② NaOH ③ HCl ④ (NH4)2SO4
A ④>①>②>③ B ②=③>①>④ C ④>①>②=③ D ④>②>①=③
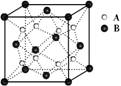 5. 某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为
5. 某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为
A.B2A B.BA2
C.B7A4 D.B4A7
6.硫酸铜遇到黄铁矿(FeS2)可以发生反应: 14CuSO4 + 5FeS2 + 12H2O = 7Cu2S + 5FeSO4 + 12H2SO4 ,在该反应中,被氧化的硫原子与被还原的硫原子的物质的量之比为:
A. 7:3 B. 3:7 C. 7:5 D. 5:7
7.某溶液中存在较多的K+、H+、I-,可以在上述溶液中大量共存的是
A.Cl-、NH4+、Na+ B.Na+、HCO3-、SO42-
C.Fe3+、Cl-、NO3- D.ClO-、Br-、NH4+
8.用铝粉和氧化铁粉末配成的铝热剂,分成两等份:一份在高温下恰好完全反应, 再与足的量稀硫酸反应,生成氢气a L;另一份直接放入足量烧碱溶液中充分反应, 在同条件下生成氢气b L,体积比a∶b为:
A. 1∶1 B. 2∶3 C. 3∶2 D. 28∶9
9.2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。
![]()
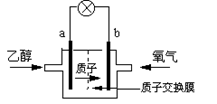 电池总反应为:C2H5OH +3O2 2CO2 +3H2O,
电池总反应为:C2H5OH +3O2 2CO2 +3H2O,
电池示意如右图,下列说法不正确的是:
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ + O2 + 4e- = 2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
二、选择题(每小题4分,每小题有一或两个选项符合题意)
10.在下列实验中,可能达不到目的的是
A.用金属钠与水或乙醇反应,比较水和乙醇分子中羟基氢(-OH)的活泼性
B.用铂(Pt)电极电解Cu(NO3)2
、AgNO3 混合溶液,比较铜和银的金属活泼性
C.检测等物质的量浓度H3PO4和 H2SO4的酸性强弱,比较磷和硫两元素非金属性的强弱.
D.向无色溶液加BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO42-
11.根据热化学方程式:S(s)+O2(g) = SO2(g);△H=-297.23 kJ/mol ,下列说法正确的是:
A.1molSO2 (g)的能量总和大于1molS(s)和1mol O2(g)的能量总和
B.1molSO2(g)的能量总和小于1molS(s)和1molO2(g)的能量总和
C.S(g)+O2(g) = SO2(g);△H= -Q kJ/mol ; Q的值大于297.23
D.S(g)+O2(g) = SO2(g);△H= -Q kJ/mol ; Q的值等于297.23
12. 设NA表示阿伏加德罗常数,下列叙述中正确的是 :
A.常温常压下,11.2 L氧气所含的原子数为NA
B.1.8 g的![]() 中含有的电子数为NA
中含有的电子数为NA
C.常温常压下,48 g O3含有的氧原子数为3NA
D.常温常压下1 mol NO2气体与水反应生成NA个![]() 离子
离子
13.容积相同的甲、乙密闭容器,甲为恒容、乙为恒压,分别充入2 molSO2和1 mol
O2,同时发生反应: 2SO2(g)+O2(g)![]() 2SO3(g),同温度下分别达到平衡,测得甲中SO2的转化率为25%,下列说法中正确的是
2SO3(g),同温度下分别达到平衡,测得甲中SO2的转化率为25%,下列说法中正确的是
A.反应过程中甲容器中的反应速率比乙中的大
B.甲容器反应达到平衡时所需时间比乙容器少
C.乙容器中SO2的转化率大于25%
D.平衡时,乙容器中SO2、O2、SO3的浓度之比一定为2:1:2
14.A、B、C均为短周期元素,A、B同周期, A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法中正确的是
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
15.从海水中提取镁,可按如下步骤进行:
① 把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
② 将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。
下列说法不正确的是
A.此法的优点之一是原料来源丰富 B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
16.氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳,若有1%的NaOH转变为Na2CO3,未知浓度的盐酸滴定25.00 mL此NaOH溶液来测定盐酸浓度,并选用甲基橙作指示剂,则盐酸浓度的测定结果会:
A.偏低1% B.偏高1% C.无影响 D.偏高0.1%
17.下列离子方程式书写正确的是
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2+ + OH- + H+ + SO42- == BaSO4↓+ H2O
B.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液
Ca2+ + 2HCO3—+2OH—====CaCO3↓+ 2H2O + CO32—
C.醋酸钡溶液和硫酸反应:Ba2++SO42-== BaSO4↓
D.向酸性FeSO4溶液中加H2O2溶液:
2Fe2+ + 2H2O2 + 4H+ ==2Fe3+ + 4H2O
18.密闭容器中,有反应:A2
+ B2 ![]() 2AB,产物AB的生成情况如图
2AB,产物AB的生成情况如图
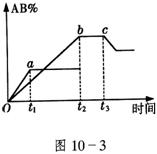 所示,a为500℃,b为300℃时的情况,c为300℃时从时间
所示,a为500℃,b为300℃时的情况,c为300℃时从时间![]() 开 始向容器中加压的情况,下列叙述正确的是
开 始向容器中加压的情况,下列叙述正确的是
A.A2、B2、AB均为气体,正反应放热
B.AB为气体,A2、B2中最少有一种为非气体,正反应吸热
C.AB为气体,A2、B2中最少有一种为非气体,正反应放热
D.AB为固体,A2、B2中最少有一种为非气体,正反应吸热
19.某溶液中只有Na+、CH3COO—、H+、OH—四种离子,且浓度大小的顺序为:
c(CH3COO—)>c(Na+)>c(H+)>c(OH— ) ,该溶液可能的情形是
A.由pH =3的CH3COOH与pH =11的NaOH溶液等体积混合而成
B.由0.2 mol/L的CH3COOH与0.1 mol/L的NaOH溶液等体积混合而成
C.在该溶液中加入适量NaOH,可使溶液中离子浓度大小改变为:
c(CH3COO—)>c(Na+)>c(OH—)>c(H+)
D.由0.1 mol/L的CH3COOH与0.1 mol/L等体积的NaOH溶液混合而成
第二部分非选择题 (共83分)
三、(本题共2小题,共20分)
20.(8分)请设计实验用氯化钙固体和其他有关试剂(硝酸银价格昂贵不能使用),制取一定量
纯净的硝酸钙固体
(1)写出表示制取硝酸钙的化学方程式:
;
。
(2)简述实验操作步骤(不要求回答使用的仪器,但要求回答试剂的用量:少量、适量或过量)
。
21.(12分)实验室利用乙醇脱水制备乙烯的步骤如下;
①在蒸馏烧瓶中加人95%的乙醇和浓硫酸的混合物(体积比为l∶3),再加入少量碎瓷片;
②瓶口插上带塞的温度计;
③加热并迅速使反应温度上升到170℃;
④气体通过稀NaOH溶液进行洗气后,再用酸性KMnO4溶液检验乙烯的还原性。
据此回答下列问题:
(1)制备乙烯的化学反应方程式为 ;
(2)①中混合乙醇和浓硫酸时应注意 ;
(3)③中使反应温度迅速升高到I7O℃的原因: ;
(4)④中NaOH溶液的作用为 ;
(5)请简述从试剂瓶中量取30mL浓硫酸的操作过程
。
四、(本题共2小题,共 23分)
22.(11分)以石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
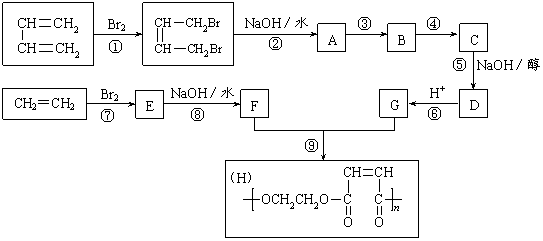
请按要求填空:
⑴写出下列反应的反应类型:
反应①________________ ,反应⑤________________,反应⑧________________ 。
⑵反应②的化学方程式: _____________________________________________ 。
![]() ⑶反应③是与HCl加成, ④是双重氧化,在 ③ ⑤中,设计③这一步反应的目的:
⑶反应③是与HCl加成, ④是双重氧化,在 ③ ⑤中,设计③这一步反应的目的:
_______________________________ 。
(4)物质C的结构简式_________________ , F的结构简式 _ .
23.(12分)四氯化钛(TiCl4)是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4和钛的反应分布为:
![]() TiO2 +2C+2Cl2
TiO2 +2C+2Cl2![]() TiCl4 +2CO ;TiCl4
+2Mg
Ti + 2MgCl2
TiCl4 +2CO ;TiCl4
+2Mg
Ti + 2MgCl2
下图是实验室制备TiCl4的反应装置,主要操作步骤:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④ 将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
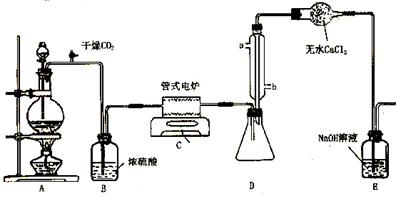
试回答下列问题:
⑴ 正确的操作顺序为(填序号)___________________________ 。
⑵ 装置A中的反应的离子方程式为__________________________________ 。
⑶ 操作①的目的是_________________________________ 。
⑷ 装置D中冷凝管进水口的位置是(填a或b)__________ ,
装置E的作用是___________________________________________________ 。
⑸ TiCl4露置于空气中极易水解,其化学方程式可表示为_____________________ 。
⑹ 工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛,
![]() TiCl4 +2Mg Ti +
2MgCl2 ,氩气的作用为__
。
TiCl4 +2Mg Ti +
2MgCl2 ,氩气的作用为__
。
五、(本题共2小题,共20分)
24. (10分)下图中所涉及的A、B、C、D、E、F、G和H都是中学化学教材中常见的物质,
E为金属单质,H是白色的胶状沉淀,参加反应或生成的水均已略去。
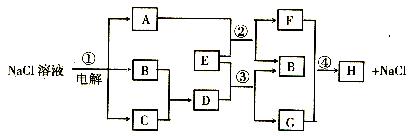
回答下列问题:
⑴ A与E的水溶液反应的化学方程式:_____________________________________。
⑵反应④ 的离子方程式:____________________________________ ;
⑶ 用惰性电极电解饱和食盐水的反应①的离子方程式为:
__________________
反应③的离子反应方程式:_ 。
若在电解所得溶液中滴入酚酞试剂,则______ 极附近溶液(填“阴极”或“阳极”)会变成红色。
25.(10分)有机物A(C8H8O2)为一种无色液体。从A出发可发生如下一系列反应
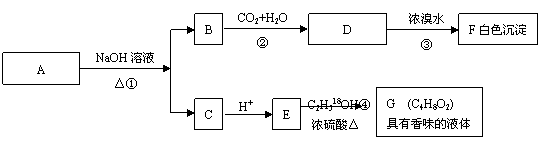 |
请回答:
(1)A和F的结构简式:A , F 。
(2)反应②的离子反应方程式: 。
反应④的化学反应方程式: 。(请注明示踪18O原子)
(3)A的同分异构体甚多,其中属于羧酸类的化合物,且含有苯环结构的异构体有____种。
六、(本题共2小题,共20分)
26.(8分)已知KMnO4、MnO2在酸性条件下将草酸钠(Na2C2O4)氧化,离子反应为:
2MnO4—+5C2O42—+16H+==2Mn2++10CO2↑+8H2O
MnO2+C2O42—+4H+==Mn2++2CO2↑+2H2O
为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g无水草酸钠固体,再加入足量的稀硫酸(杂质不反应),充分反应后将所得溶液转移到250mL容量瓶中, 用蒸馏水稀释至刻度,摇匀后从中取出25.00mL,再用0.02mol/L KMnO4溶液滴定。当滴入20.00mLKMnO4溶液时恰好完全反应。
求该软锰矿中MnO2的质量分数。
27.(12分)设在NO2和O2的混合气体中,NO2所占的体积分数为x , 用容积为50mL的容器盛满该混合气体并倒立于水中,足够长的时间后,容器内最终剩余10 ml气体。
(1)求原混合气体中NO2的体积分数x;
(2)若原50 mL混合气体中含有少量N2(小于1 mL),请判断在上述条件下,这些N2的
存在对第(1)小题的计算结果有无影响?
广东省惠州市2006届高三第一次调研考试
化学试题答题卷
| 题目 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 答案 | ||||||||||
| 题目 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 答案 |
![]()

三、填空题(共2小题,共20分)
20.(8分):
(1): ;
。
(2):
。
21.(12分)
(1) ;
(2) ;
(3) ;
(4) ;
(5)
。
四、填空题(本题共2小题,共 23分)
22. (11分)⑴. ①______________,⑤_____________,⑧_____________ 。
⑵_____________________________________________ 。
(3)_______________________________ 。
(4)_________________ ; _
23.(12分)
⑴ ___________________________ 。
⑵ _________________________________ ;
⑶ ________________________________ ;
⑷ __________ ,装置E的作用________________________ ;
⑸ _____________________ ;
⑹ 氩气的作用为__ 。
五、(本题共2小题,共20分)
24. (10分)
⑴ __________________________________________ 。
⑵ ____________________________________ ;
⑶:
①__________________ ,
③ ; _____ 极。
25.(10分)
(1):A , F ;
(2):
②: ;
④: 。
(3)_____ 种。
六、计算题(共2小题,共20分)
26.(8分)
![]()
27.(12分)
广东省惠州市2006届高三第一次调研考试
参考答案和评分标准
一、二:1.B、 2.D、 3.A、 4.C、 5.B、6.B、7A 、8. B、9.D、10.D、11.BC 12.BC、13.C 、14.AC、15.B、16.C、17.B 、18C、19.AB
三、填空题(共2小题,共20分)
20.(8分) (1)CaCl2+Na2CO3=CaCO3↓+2NaCl (2分)
CaCO3+2HNO3=Ca(NO3)2+H2O+CO2 ↑ (2分)
(2) 用蒸馏水溶解CaCl2,加足量Na2CO3溶液,过滤,用蒸馏水洗涤沉淀,加足量HNO3,使沉淀溶解,将所得溶解溶液蒸发、结晶 (4分)
21. (12分) (1)C2H5OH![]() C2H4 ↑+
H2O
(2分)
C2H4 ↑+
H2O
(2分)
(2)将浓硫酸缓慢加入乙醇中并不断搅拌 (2分)
(3)140 ℃时,生成的物质主要是乙醚并非乙烯。 (2分)
(4)除去反应生成的CO2及SO2(2分)
(5)取下盛浓硫酸的试剂瓶盖,倒放于桌面,标签对着手心,瓶口靠紧量筒,倒入浓硫酸接近刻度,改用胶头滴管滴至液体凹面和30 mL刻度相平,盖紧瓶盖。 (4分)
四、填空题(共2小题,共23分)
22. (11分).⑴加成反应 消去反应 取代反应
(3分)
⑵![]() +2NaOH→
+2NaOH→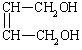 +2NaBr (2分)
+2NaBr (2分)
⑶ 保护A分子中C=C不被氧化 (2分)
(4) 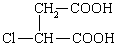 (2分)
HOCH2CH2OH (2分)
(2分)
HOCH2CH2OH (2分)
23.(共12分)⑴ ③①④② (2分)
②
MnO2+4H+ +2 Cl-![]() Mn2+ + Cl2↑+2H2O
(2分)
Mn2+ + Cl2↑+2H2O
(2分)
⑵ 排尽装置内的空气,避免TiCl4 遇空气中水蒸气发生水解 (2分)
⑶ b (1分),⑷吸收多余的Cl2,以免污染空气(2分)
⑸TiCl4 + 4H2O == 4HCl + Ti(OH)4(2分) ⑹防止Mg和Ti被空气中氧气氧化 (2分)
五、(共2小题,共20分)
24.(10分) ⑴ 2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑
⑵ Al3+ + 3AlO2—+ 6H2O == 4Al(OH)3↓,
⑶
2Cl—+2H2O ![]() 2OH—+Cl2↑+ H2↑, 2Al+ 6H+=====2Al3+ + 3H2↑ 阴(每问2分,共10分)
2OH—+Cl2↑+ H2↑, 2Al+ 6H+=====2Al3+ + 3H2↑ 阴(每问2分,共10分)
![]()
 25. (10分) (1)(各2分
)
CH3COO-
25. (10分) (1)(各2分
)
CH3COO-
![]() (2))C6H5O— + CO2 + H2O
C6H5O— + HCO3—
(2分)
(2))C6H5O— + CO2 + H2O
C6H5O— + HCO3—
(2分)
C2H518OH +CH3COOH=====CH3CO18OC2H5 + H2O (2分)
(3)4(2分)
六、计算题(共2小题,共20分)
26.(8分)解 :
5C2O![]() ~ 2MnO
~ 2MnO![]()
5 2
x mol 0.02×20×10-3 mol
x= 1×10-3 mol (2分)
∴用于与MnO2反应的C2O![]() 为:
为:
(![]() — 1×10-3mol×
— 1×10-3mol×![]() ) =0.01mol
(2分)
) =0.01mol
(2分)
∵MnO2 ~ C2O![]()
1 1
y mol 0.01 mol
y = 0.01 mol (2分)
∴MnO2%=![]() ×100%=72.5%
(2分)
×100%=72.5%
(2分)
答:(略)
27. (12分)解:混合气体在水中可能发生的反应:
①:4NO2+O2+2H2O=4HNO3; ②:3NO2+H2O=2HNO3+NO
(1) 当反应①中剩余气体为O2,其体积和x的关系为:
10=50-(50x+50x/4)=50-62.5x (2分) 10=50-62.5x 得x=64% (2分)
当①中当NO2过量,剩余气体NO体积和x的关系为:
10=![]() {50-[(1-x)×50+(1-x)×50×4]}=
{50-[(1-x)×50+(1-x)×50×4]}=![]() (250x-200) (2分)
(250x-200) (2分)
10=![]() (250x-200)得x=92%
(2分)
(250x-200)得x=92%
(2分)
(2)若混合气中有1mLN2,在x=64%时,![]()
仍然是O2过量,对计算所得NO2的体积分数(64%)没有影响。 (2分)
若剩余的10mL气体是NO和N2,只有9mLNO,反应①剩余NO2的体积为27mL,反应①中消耗的NO2的体积=![]() 17.6 mL。混合气体中NO2的实际体积分数:=
17.6 mL。混合气体中NO2的实际体积分数:=![]() =89.2%<92%。即在题设条件下,少量N2的存在使计算所得NO2的体积分数偏小。
(2分)
=89.2%<92%。即在题设条件下,少量N2的存在使计算所得NO2的体积分数偏小。
(2分)