★4月x日前绝密★

化 学
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。第I卷从第1页至第4页,第II卷从第4页至第8页,满分150分。考试时间120分钟。考试结束后,将第I卷答题卡和第II卷答题纸一并交监考老师。
注意事项:
1.答题前,考生先将自己的姓名、考试证号等填写清楚,并认真核对答题卡表头及答题纸内规定填写或填涂的项目;
2.第I卷答案必须用2B铅笔填涂在答题卡上,在其他位置作答一律无效。每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。
3.答题应答在答题卡中规定的区域内,在草稿纸、试卷上答题无效;保持字迹工整、笔迹清楚;
可能用到的相对原子质量:H:1 D:2 Si:28 C:12 O:16 Ca:40 S:32 Pb:207
Ag:108 I:127 Na:23 Fe:56 Br:80 Cu:64 N:14 Al:27 Cl:35.5 B:11
第I卷 (选择题 共60分)
一、选择题(本题包括5小题,每题4分,共20分。每小题只有一个选项符合题意)
1.一种新型材料B4C,它可用于制作切削工具和高温热交换器。关于B4C的推断正确的是
A.B4C是一种分子晶体 B.B4C是一种离子晶体
C.B4C是一种原子晶体 D.该分子是有4个硼原子和1个碳原子构成
2.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC)等种类。PVC被广泛地用于食品、蔬菜外包装,它对人体有潜在危害。下列有关叙述不正确的是
A.PVC保鲜膜属于链状聚合物,在高温时易熔化,能溶于酒精
B.PVC单体可由PE的单体与氯化氢加成制得
C.鉴别PE和PVC,可把其放入试管中加热,在试管口放置一湿润的蓝色石蕊试纸,如果试纸变红,则是PVC;不变红,则为PE。
D.等质量的聚乙烯和乙烯燃烧消耗的氧气相等
3.下列有关叙述正确的是
A. “神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
 B.“加碘食盐” “含氟牙膏”“富硒营养品” “高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
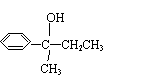
B.“加碘食盐” “含氟牙膏”“富硒营养品” “高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
C. 右图是反应物和生成物的能量变化示意图,则其可能发生的反应的热化学方程式可表示为:
2 A(g)+ B(g) = 2 C(g);△H=Q kJ·mol-1(Q<0 )
D.电解水制取氢气和氧气时,通常加入硫酸钠等强电解质,这说明强电解质的导电性比弱电解质的强
4.下列有关说法正确的是
A.溴乙烷水解后的碱性溶液不能用硝酸酸化,因为硝酸会把Br—氧化,再加入AgNO3溶液则不会产生浅黄色沉淀
B.为提高高锰酸钾溶液的氧化能力,用盐酸将KMnO4溶液酸化
C.证明CH3CH2CH=CHCH2CHO分子中有碳碳不饱和键的方法:向其中加酸性高锰酸钾溶液,高锰酸钾溶液褪色
D.检验溶液中是否含有SO42-时,在无其它阳离子干扰时,所加的BaCl2溶液用盐酸酸化
5. 24g石英和80g石灰石在高温下充分反应,放出的气体在标准状况下的体积是
A.4.48L B.8.96L C.11.2L D.17.92L
二、选择题(本题包括10小题,第6~15小题每小题4分,共40分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
6.NA表示阿伏加德罗常数,下列说法中正确的是
A.3.6 g重水中所含质子数为2NA
B.4.48 L N2所含分子数为0.2 NA
C.12g金刚石中含有碳碳键的个数为2NA
D.1 molS与足量Cu反应生成Cu2S转移NA个电子
| a | ||||
| b | c | |||
| d | e | |||
| f |
7.右图中a、b、c、d、e、f为元素周期表中前4周期的相邻的一部分元素,下列有关叙述正确的是
A.b、c、e三种元素的单核离子半径大小关系: e>b>c
B.六种元素中,d元素的性质最稳定
C.c的氢化物沸点比f氢化物的沸点低
D.b元素除0价外,只有一种化合价
8.2005年11月黑龙江中化石油某苯厂发生爆炸,使松花江发生了严重的水污染,2006年3月苏州市某酚醛树脂厂的排放的污水中苯酚等物质严重超标,使当 地很多人饮用自来水而中毒。下列有关苯和苯酚的有关叙述正确的是
A.苯和苯酚分子中所有的原子都在同一平面上
B.苯酚比苯易与溴发生取代反应,说明羟基对苯环的影响使苯环上的氢活泼性增强
C.某污水是否含有苯酚,可以加入三氯化铁看溶液是否呈紫色
D.除去苯中混有的苯酚,可以加入溴水充分反应后分液
9.向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3: 1其原因可能是
A.两溶液的体积相同,酸是多元强酸
B.若酸为一元强酸,酸溶液的体积是碱溶液体积的3倍
C.两溶液的体积相同,酸是弱酸
D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
10.下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是
| (I) | (II) | |
| A | 少量SO2通入Ba(OH)2溶液 | 过量SO2通入少量Ba(OH)2溶液 |
| B | 少量浓氨水滴入Al2(SO4)3溶液 | 少量Al2(SO4)3溶液滴入浓氨水 |
| C | 0.1mol Cl2通入含0.2mol FeBr2的溶液 | 0.3 molCl2通入0.2molFeBr2溶液中 |
| D | 过量BaCl2溶液与少量Na2SO4溶液相混合 | 少量Ba(NO3)2溶液与过量MgSO4溶液相混合 |
11.把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
A.SO2 B.Cl -
C.Fe3+ D.NO3 -
12.下列各溶液中,微粒的物质的量浓度关系正确的是:
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
13.某学生设计了如图的方法对A盐进行鉴定:
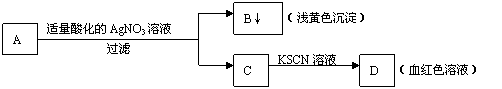 |
由此分析,下列结论中,正确的是
A.A中一定有Fe3+ B.C中一定有Fe3+
C.B为AgI沉淀 D.A一定为FeBr2溶液
14.如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol Z,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?)![]() 3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是
3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是
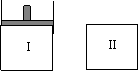
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时X的产率:Ⅰ>Ⅱ
C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ
D.若X为固态,Y为气态,到达平衡后若在Ⅱ中再加入1molZ,则新平衡时Z的体积分数变小
15. 某结晶水合物的化学式为A·nH2O,其相对分子质量为M,在25℃时,ag晶体溶于bg水中即达饱和,形成密度为ρg/mL的溶液,下列表达式正确的是
A.饱和溶液的物质的量浓度为:1000a(M-18n)/M(a+b)mol/L
B.饱和溶液中溶质的质量分数为:100a(M-18n)/M(a+b)%
C.饱和溶液的体积为:(a+b)/ρL
D.25℃时,A的溶解度为:a(M-18n)/(bM+18an)g
第II卷 (非选择题 共90分)
三、(本题包括2小题,共22分)
16.(7分)(1)下面所列的是中学化学实验室中几种常见的仪器:
容量瓶 、酸式滴定管、碱式滴定管、温度计、量筒 、托盘天平、 普通漏斗 、烧杯
①若要进行中和滴定实验,还缺少的玻璃仪器是 ;
②若要用碳酸钠固体配制一定物质的量浓度的碳酸钠溶液,还缺少的玻璃仪器是 ;
③使用酸式滴定管的第一步操作是 ;
④中和热测定时,一次完整实验,温度计应使用 次。
(2)下列实验最后结果与理论值相比,偏小的是
A.配制一定物质的量浓度溶液时,药品与砝码放反了,游码读数为0.3g,所得溶液的浓度
B.酸碱中和滴定时,滴定终点仰视标准液滴定管读数,所得待测液的浓度
C.中和热测定实验时,用铜质搅拌棒代替环形玻璃搅拌棒,所得的中和热的数值
D.测定硫酸铜晶体结晶水含量时,坩埚内有高温不分解的固体物质,所得到的结晶水的含量
17.(15分) 为清楚地看到无色NO遇空气变为红棕色(或浅棕色)的过程。某化学兴趣小组的甲、乙两位同学分别设计如下两个实验:
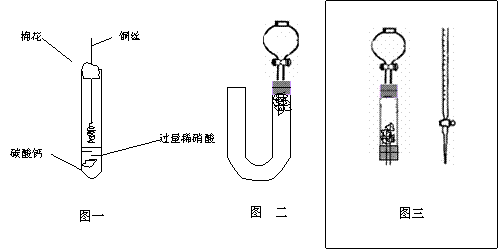
(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸 ②如图塞好疏松的棉花和铜丝 ③一段时间后,使铜丝浸入过量的硝酸反应 ④慢慢向试管底部推入棉花,可见明显现象。 第①步放入大理石的作用是:
(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞, NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色。但按他的方法实际操作的丙同学发现此法至少存在两个问题:
①当酸液加到浸没分液漏斗下端管口以后,会 而使后面的实验无法观察到预期现象。
②反应开始后,因为随着NO的体积增加, 影响铜丝与硝酸的继续反应。
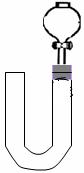 (3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在答题卷相应图上(如左)补齐装置并特别画出铜丝的适当位置:
(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在答题卷相应图上(如左)补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来。为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达 ,设定有条件精确称量,还
需要的数据是
(5)计算知:将等体积NO和O2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考。已知氢氧化钠溶液可以吸收NO2,方程式为2NaOH+2NO2=NaNO2+NaNO3+H2O,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为2NaOH+NO2+NO=2NaNO2+H2O,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释:
四、(本题包括3小题,共34分)
18.(8分)某同学查资料得知α-AgI是一种固体导体,导电率很高。他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如下图所示(用铅蓄电池做电源)的电化学实验。
已知铅蓄电池总反应: 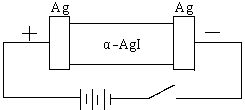 Pb+PbO2+2H2SO4
Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O
2PbSO4+2H2O
(1)该电解池的阳极电极方程式:
铅蓄电池的正极电极方程式:
(2)若Ag+导电,α-AgI本身质量将 。(填不变、变大、或变小)
若I-导电,阳极附近的α-AgI晶体密度将会 。(填不变、变大、或变小)
(3)若通电一段时间后铅蓄电池中消耗了1molH2SO4,则电解池的阴极增重 g。
19.(14分)硼酸晶体呈片状,有滑腻感,可作润滑剂,硼酸对人体的受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面。试回答下列问题:
(1)从题目信息可知硼酸应属于 酸(弱、强、中强)
(2)硼酸的分子式为H3BO3,已知H与O成键,则其分子结构式为: 。
(3)研究表明:在大多数情况下,元素的原子在形成分子或离子时,其最外层具有达到8电子稳定结构的趋向。已知0.01mol硼酸可以被20mL 0.5mol·L -1NaOH溶液恰好完全中和,据此推测硼酸在水溶液中酸性的原因是(用离子方程式表示)
写出硼酸与NaOH溶液反应的化学方程式:
(4)硼酸和甲醇在浓硫酸存在的条件下,可生成挥发性硼酸酯,试写出硼酸完全酯化的方程式:
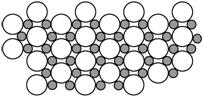 (5)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为
(5)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为
(6)核磁共振氢谱(PMR)是研究有机物结构的有力手段之一。在所研究的化合物分子中,每一结构中的等性氢原子在PMR谱中都给出了相应的峰(信号)。谱中峰的强度与结构中的H原子数成正比。例如:乙醛的PMR谱中有2个信号峰,其强度之比为3:1。某硼烷的核磁共振氢谱有两个峰且强度比为1:2,
已知其相对分子质量为28,试写硼烷可能的结构式
该硼烷气体在空气中能剧烈燃烧,生成1mol液态水可放出722kJ的热量,请写热化学方程式:
20.(12分)已知A是常见气体,K是石油化学工业的重要的基础原料,是一种植物生长调节剂,G是一无色液体,D、E、I、J四种物质中含同一种元素。图中一些反应条件和产物已省去。
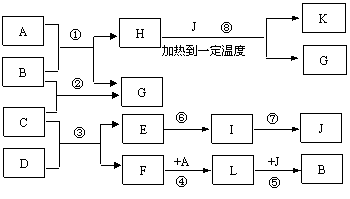 |
(1)工业上反应③在 _______________中进行,反应⑦在_______________(均填工业设备名称)中进行。反应⑥的条件是________ _______。
(2)除反应③、⑦外,还有 反应是工业反应。(填数字序号)
(3)反应①的化学方程式是______________________________________________。
反应③的化学方程式是______________________________________________。
反应⑧的化学方程式是______________________________________________。
五、(本题包括2小题,共18分)
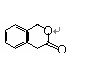
21.(8分)A为某芳香烃的衍生物,只含C、H、O三种元素,环上有两个取代基。又已知A的相对分子质量为150,A不能使FeCl3溶液显色,但可被新制Cu(OH)2氧化为B,B能浓硫酸存在和加热时,发生分子内的酯化反应生成C,C分子中有一个含氧的六元环。
(1)写出符合上述条件的B的可能的结构式:
(2)写出任意一种B生成的C的结构简式:
(3)含有苯环的属于酸的A的同分异构体的有 种
22.(10分)已知:
①卤代烃(或![]() -Br)可以和金属反应生成烃基金属有机化合物。后者又能与含羰基化合物反应生成醇:
-Br)可以和金属反应生成烃基金属有机化合物。后者又能与含羰基化合物反应生成醇:
RBr+Mg![]() RMgBr
RMgBr![]() RCH2OMgBr
RCH2OMgBr![]() RCH2OH
RCH2OH
②有机酸和PCl3反应可以得到羧酸的衍生物酰卤:![]()
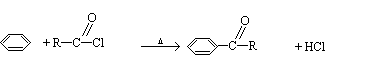 |
③苯在AlCl3催化下能与酰卤作用:
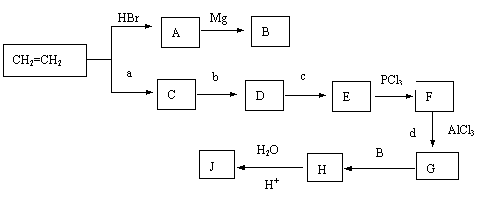 请以最基础的石油产品(乙烯、丙烯、丙烷、苯等)并任选无机试剂为原料依下列路线合成J,已知J分子式为C10H14O,
请以最基础的石油产品(乙烯、丙烯、丙烷、苯等)并任选无机试剂为原料依下列路线合成J,已知J分子式为C10H14O,
(1)写出下列反应的反应类型:C→D: F→G:
(2)写出E和J的物质的结构简式:E: J:
(2)写出下列反应方程式:
D→E:
G→H:
六.(本题包括2小题,共16分)
23.(6分)在c(NO3_)等于4mol/L的Cu(NO3)2和AgNO3的100mL混合液中,加入一定量的铝粉,充分反应后,过滤,将滤纸上的沉淀干燥后,称量为24.8g,将此沉淀溶于稀盐酸中无气体产生;滤液中滴入NaCl溶液无现象,然后加入过量的稀NaOH溶液得到沉淀,过滤,将沉淀物用酒精灯加热,冷却称重为4.0g,求参加反应的铝的质量。
24.(10分)根据烷、烯、炔烃燃烧的反应式,有人总结出以下规律:对于烷烃有n(烷烃)=n(H2O)-n(CO2),对于烯烃有n(H2O)-n(CO2)=0,对于炔烃有n(炔烃)=n(CO2)-n(H2O)。请回答下列问题:
(1)某混合气体由C2H6和C3H4组成。将1.0体积混合气在氧气中充分燃烧,产生的CO2体积比水蒸气多0.2体积(相同状况下测定),通过计算确定C2H6和C3H4的体积。(设体积单位为升)
(2)某混合气由烯烃和烷烃或烯烃和炔烃组成。组成中可能是两种气体,也可能是多种气体。将1.0体积混合气在氧气中充分燃烧,产生3.0体积CO2和2.4体积水蒸气(相同状况下测定)
①判断混合气体有________________两类烃组成。
②上述判断的理由是________________________________________________________.(用简要文字叙述)。
③上述两类烃的体积比为__________________________

化 学参考答案
1.C 2.B 3.C 4.D 5.D 6.C 7.A 8.BC 9.C 10.BD 11.D 12.AD 13.B 14.CD 15.B
16.(1)①锥形瓶(1分)②玻璃棒、胶头滴管(2分)③检查是否漏水(1分)④三(1分)(2)A、C(2分,一对一错0分)
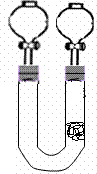 17.(1)排出试管中的空气(2分)
17.(1)排出试管中的空气(2分)
(2) ①因如图所示的铜丝所在空间中被封闭一段空气;(2分)
②产生的NO排开酸液而与大部分铜丝脱离接触。(2分)
(3)正确画出如右图得2分。左边下端漏斗口露出橡皮塞也正面确。
若左边画一普通漏斗,亦给分。
(4)分液漏斗最大量程刻度处。(2分)
铜丝反应前后的质量(2分)
(5)2NO2+H2O =HNO2+HNO3 NO2+NO+H2O =2HNO2 4NO+O2+2H2O =4HNO2
在此反应条件下,氮氧化物(NO、NO2)的最终产物并非HNO3一种,实际存在着较低价态的HNO2,实际消耗氧气的量将要减少。(3分)
(答出一条以上反应,讲出耗氧量减小的意思,都给满分。
18.(1)Ag-e-=Ag+ ,(2分)PbO2+4H++SO42-+2e-=PbSO4+2H2O(2分)
(2)不变,变大(2分)
(3)108(2分)
19.(1)弱 (1分)
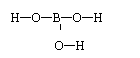 (2)
(1分)
(2)
(1分)
(3)B(OH)3+H2O [B(OH)4]—+H+ (2分)
B(OH)3+NaOH=NaBO2+2H2O (2分)
 (4)B(OH)3+3CH3OH
(4)B(OH)3+3CH3OH![]() B(OCH3)3—+3H2O (2分)
B(OCH3)3—+3H2O (2分)
(5)MgB2;(2分) (2分)
(6)B2H6(g)+3O2(g)
= B2O3(s) + 3H2O(l);![]() H= - 2166kJ·mol-1 (2分)
H= - 2166kJ·mol-1 (2分)
20.(1)沸腾炉,(1分)吸收塔,(1分)常压、催化剂、400∽500℃.(2分)
(2)①④⑥ (2分)
![]() (3)2CO+4H2
CH3CH2OH+H2O (2分)
(3)2CO+4H2
CH3CH2OH+H2O (2分)
4FeS2+11O2![]() 2Fe2O3+8SO2 (2分)
2Fe2O3+8SO2 (2分)
![]()
CH3CH2OH CH2=CH2+H2O (2分)
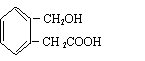
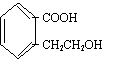 21.(1)
21.(1)
还有间位一种 (4分)
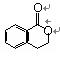 |
(2) 或 (2分)
(3)14 (2分)
 |
22.(1) (2分)氧化;取代
(2)CH3COOH;(2分) (2分)
(3)2CH3CHO+O2![]()
![]() 2CH3COOH(其他合理也给分)(2分)
2CH3COOH(其他合理也给分)(2分)
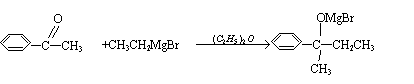 |
(2分)
23.(6)
解:设加进的铝的物质的量为xmol,根据硝酸根守恒列式:
4mol/L×100×10-3L=3xmol+![]() ×2,
x=0.1mol, m(Al)=2.7g
×2,
x=0.1mol, m(Al)=2.7g
其它合理解法也得分。
24.(10分)
(1) 设混合气体中C2H6和C3H4的体积分别为aL和bL,由两个反应式可得出下列关系:
C2H6+3.5O2→2CO2+3H2O; C3H4+4O2→3CO2+2H2O;
a 2a 3a b 3b 2b
![]()
![]() a + b = 1.0 L
a=0.4L
a + b = 1.0 L
a=0.4L
(2a+3b)-(3a+2b)=0.2L (2分) b=0.6L (2分)
(2)①炔烃、烯烃;(2分) ②因为V(H2O) <V(CO2),即n(H2O) <n(CO2),肯定有炔烃,又由题意知,另一种为烯烃,故为炔和烯两类烃。(2分) ③V炔︰V烯=6︰4;(2分)