2005-2006学年高三年级化学同步测试题
第四单元 电解原理及其应用单元测试题
一.选择题(每题3分,共24分,每题只有一个选项符合题意)
1.铁棒和石墨棒用导线连接后,浸入0.01mol·L-1的食盐溶液中,可能出现的现象是
A.铁棒附近产生OH- B.铁棒被腐蚀
C.石墨棒上放出O2 D.石墨棒上放出Cl2
2.PH = a 的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的PH >a,则该电解质可能是:
A.NaOH B.H2SO4 C.AgNO3 D.Na2SO4
3.用惰性电极进行电解,下列说法正确的是:
A.电解稀硫酸溶液,实质上是电解水,故溶液PH不变
B.电解稀氢氧化钠溶液,要消耗OH—,故溶液PH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
4.某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3 :1。用石墨作电极电解该混合溶液时,根据电极产物,可明显分为三个阶段。下列叙述不正确的是
A.阴极自始自终只析出H2 B.阳极先析出C12,后析出O2
C.电解最后阶段为电解水 D.溶液pH不断增大,最后为7
5.下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
6.下图中验证氯化钠溶液(含酚酞)电解产物的装置是
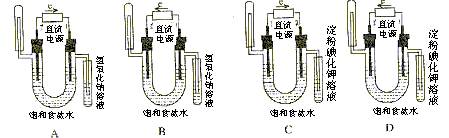
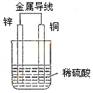 7.关于如图所示装置的叙述,正确的是
7.关于如图所示装置的叙述,正确的是
A.铜是阳极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
8.关于使用惰性电极电解NaCl水溶液,下列叙述正确的是
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI试液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
二.选择题(每题3分,共24分,每题有1个或2个符合题意的选项)
9.在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是
A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应
10.食盐中加有KIO3,KIO3在工业上以石墨和铁为电极,用电解KI溶液方法制取。以下有关说法不正确的是
A.电解时,石墨作阴极,铁作阳极
B.阴极的电极反应式为:2H+ + 2e—==H2↑
 C.电解过程中阳极周围溶液的PH变大
C.电解过程中阳极周围溶液的PH变大
D.理论上每生成1mol KIO3则电路中流过6mole—
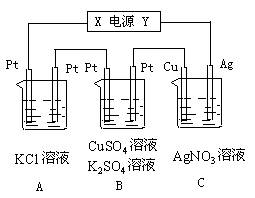
11.右图装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,下列说法中正确的是
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的pH逐渐减小
D.CuSO4溶液的pH保持不变
12.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt 等杂质,可用电解法制备高纯度的
镍,下列叙述正确的是
(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— == Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
13.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2—。下列对该燃料电池说法正确的是
A.在熔融电解质中,O2— 由负极移向正极
B.电池的总反应是:2C4H10 + 13O2→ 8CO2 + 10H2O
C.通入空气的一极是正极,电极反应为:O2 + 4e— = 2O2—
D.通入丁烷的一极是正极,电极反应为:C4H10 + 26e— + 13O2—== 4CO2 + 5H2O
14.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
下列叙述不正确的是
A.放电时负极反应为:Zn — 2e— + 2OH— == Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 — 3e— + 5OH— == FeO42— + 4H2O
C.放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
15.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-===Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
16.将含有0.400molCu(NO3)2和0.400molKCl的水溶液1L,用惰性电极电解一段时间后,在一个电极上析出0.300molCu,此时在另一电极上放出的气体在标准状况下的体积为
A.3.36L B.6.72L
C.5.60L D.大于5.60L,小于6.72L
三.填空题
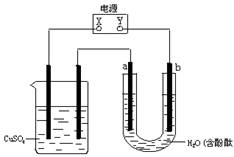
17.(6分)如图所示,若电解5min时铜电极质量增加2.16g,试回答:
⑴ 电源电极X名称为_____________。
⑵ PH变化:A_____________,B_______________,C_______________。
⑶ 通过5min时,B中共收集224mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度为______________。
⑷ 若A中KCl溶液的体积也是200mL,电解后溶液的PH = __________。
18.(6分)⑴ 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源。氢氧燃料电池的突出优点是把化学能直接转化为电能,而不经过热能中间形成,而电极反应产生的水,经过冷凝后又可作为宇航员的饮用水,发生的反应为:![]() 则负极通的应是_________,负极反应式为_________________。
则负极通的应是_________,负极反应式为_________________。
⑵ 如把KOH改为稀硫酸作导电物质,则负极反应式为_____________________,⑴和⑵的电解液不同,反应后溶液的PH各有何变化?
⑴中PH________________________ ⑵中PH__________________________
⑶ 如把H2改为CH4,KOH作导电物质,则负极反应式为_____________________。
19.(6分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
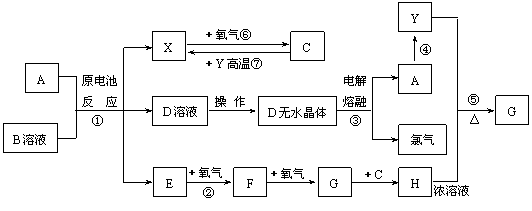 |
请填写下列空白:
⑴ 反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
⑵ 从D溶液制备D的无水晶体的“操作a”为 。
⑶ 反应②的化学方程式为 。
⑷ 反应⑤的化学方程式为 。
⑸ 原电池反应①中正极的电极反应式为 。
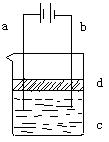 20.(7分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得白色、纯净的Fe(OH)2沉淀。应用如图所示电解实验可制得Fe(OH)2沉淀。两电极的材料分别为铁和石墨。
20.(7分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得白色、纯净的Fe(OH)2沉淀。应用如图所示电解实验可制得Fe(OH)2沉淀。两电极的材料分别为铁和石墨。
⑴ a电极材料应为_________,电极反应式为_____________。
⑵ 电解液c可以是___________(选填编号)
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
⑶ d是苯,其作用为_____________________,在加入苯之前应对c溶液进 行如何处理?_____________________________。
⑷ 为了在较短时间内看到白色沉淀,可采取的措施是_____(选填编号)
A.改用稀硫酸做电解液 B.适当增加电源的电压
C.适当减小两电极间距离 D.适当降低电解液的温度
⑸ 若c用硫酸钠溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除在电极上可以看到气泡外,混合物中另一明显现象为_____________________________________。
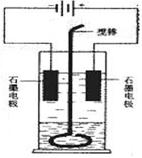 21.(7分)在玻璃圆筒中盛有两种无色的互不相容的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
21.(7分)在玻璃圆筒中盛有两种无色的互不相容的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(1)阳极上的电极反应式为 。
(2)阴极上的电极反应式为 。
(3)原上层液体是 。
(4)原下层液体是 。
(5)搅拌后两层液体颜色发生变化的原因是 。
(6)要检验上层液体中含有的金属离子 ,现象是 。
22.(6分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
① X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
⑴ Z2Y的化学式是
⑵ Z2Y2与X2Y反应的化学方程式是 。
⑶ 如图所示装置,两玻璃管中盛满滴有酚酞的溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
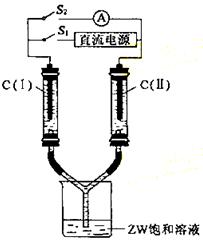
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:C(Ⅰ)的电极名称是 (填写正极或负极);C(Ⅱ)的电极反应式是 。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是: 。
四.计算题
23.(6分)有一硝酸盐晶体,其化学式为M(NO3)x·nH2O,式量是242,取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.01mol电子发生转移时,溶液中金属离子全部析出,经称量,阴极增重0.32g。求:
⑴ 金属M的相对原子质量,及x、n的值
⑵ 电解后溶液的PH(假设电解前后溶液的体积不变)
24.(8分)20℃时食盐的溶解度为36g,取一定量该温度下的饱和食盐水用惰性电极进行电解,当阳极析出11.2L(标准状况)气体时,食盐完全电解,所得溶液密度为1.20g/mL,试计算
(1)电解前,饱和食盐水的质量是多少?
(2)电解后溶液中NaOH的物质的量浓度是多少?
(3)要使溶液恢复原状态,需加入多少克什么物质?
第四单元电解原理及其应用单元测试题参考答案:
一.选择题
1.B 2.A 3.D 4.D 5.C 6.D 7.D 8.B
二.选择题
9.BC 10.AC 11.AC 12.D 13.BC 14.C 15.C 16.C
三.填空题
17.⑴ 负极 ⑵ 增大,减小,不变 ⑶ 0.025mol/L ⑷ 13
18.⑴ H2,负极:H2—2e—+2OH—==2H2O
⑵ 负极:H2—2e—==2H+,⑴中PH变大,⑵中PH变小
⑶ 负极:CH4—8e—+10OH—==CO32—+7H2O
|
(3)4NH3+5O2 ==== 4NO+6H2O (4)C+4HNO3(浓)====CO2↑+4NO2↑+2H2O
(5)2NH4++2e— = 2NH3↑+H2↑
20.⑴ Fe,Fe -2e—==Fe2+ ⑵ BC ⑶ 隔绝空气,加热煮沸 ⑷ BC
⑸ 白色沉淀逐渐转变成灰绿色,最后转变成红褐色
21.(1)2I-—2e-=I2 (2)2H++2e -= H2↑(3)NaI或KI (4)四氯化碳
(5)I2易溶于四氯化碳,难溶于水
(6)焰色反应。若焰色为黄色为NaI,通过蓝色钴玻璃观察,若焰色为紫色为KI。
22.⑴ Na2O ⑵ 2Na2O2 +2H2O == 4NaOH + O2↑
⑶ 负极 Cl2 + 2e—== 2Cl— ⑷ Cu + H2O2 + 2H+ == Cu2+ + 2H2O
四.计算题
23.⑴ 64,x=2,n=3 ⑵ PH =1
24.(1)221g (2)5.4mol·L-1 (3)通入36.5gHCl气体