2006年徐汇区高三年级化学学习能力诊断题
本卷所需相对原子质量:H-1、He-4、S-32、Mg-24、Fe-56
一、选择题(本题共10分),每小题2分,只有一个正确选项。
1、最近我国科学家制成了比黄金还贵重的氧-18的气体,氧-18是氧元素的一种稳定同位素,被称为重氧。则由重氧和重氢组成的水与普通水的有关叙述中正确的是
A、每个分子含有相同的质子数 B、每个分子含有相同的中子数
C、 具有相同的分子量 D、若两者质量相同,则所含分子数也相同
2、化肥的过量施用和城市污水的排放,会使地下水含氮量升高,其中对人体有害的含氮化合物的主要形态是
A、 NO3- B、NO2- C、NH4+ D、NH3
3、SO2 是常见的大气污染物之一,我国规定空气中SO2 含量不得超过0.02mg/L。下列措施中不能够减少SO2排放量的是
A、用天然气代替煤炭做民用燃料 B、提高热能和利用率
C、硫酸厂采取措施提高尾气的吸收率 D、燃煤中加入生石灰后使用
4、下列叙述从化学角度分析,其中错误的是
A、 被蜜蜂蛰咬后,可涂抹稀氨水或小苏打溶液减轻疼痛
B、 HgCl2的稀溶液可用于手术器械消毒,原因是可使蛋白质凝固
C、 燃料煤脱硫后使用,可减少对大气的污染
D、氟利昂(CCl2F2)或NOx都可破坏臭氧层,而导致“温室效应”
5、 在卫生间放一盆溶液,有利于消除卫生间的氨气味,盆中的溶液最好是
A、NaOH 溶液 B.氯化纳溶液 C、小苏打溶液 D.醋酸溶液
二、选择题(本题共36分),每小题3分,只有一个正确选项。
6、下列离子方程式书写正确的是
A、NaHS水解:HS- + H2O → H3O+ + S2-
B、钠与CuSO4 溶液反应:2Na十Cu2+ → Cu + 2Na+
C、向CaCl2 溶液中通人少量CO2 气体:Ca2+ + CO2 + H2O → CaCO3 +2H+
D、向100mL 0.1mol/L的NaOH溶液中通入0.224L(标准状况)CO2气体:
OH- + CO2 → HCO3-
7、下列各组微粒中,核外电子总数相等的是
A、Na+ 和Li+ B、CO和CO2
C、H2O 和H3O+ D、NO和CO
8、将99.5m1浓度为 0.2mol/L氢氧化钠溶液加到100.5mL 0.1mol/L硫酸中,所得溶液的PH值为
A、l B、2.7 C、3 D、3.3
9、由无水醋酸钠与碱石灰共热可得甲烷。你预测将无水苯乙酸钠与碱石灰共热时,所得的有机物主要是( )
A、苯 B、甲苯 C、乙苯 D、苯甲酸钠与甲烷
 | |||||
 | |||||
 | |||||
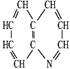
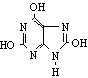
10、已知 为含氮的环状有机物,其结构可以简化为 。尿酸
的分子式为
A、C5H10N4O3 B、C9H12O3 C、C5H4N4O3 D、C6H6N4O3
11、A、B、C、D都是主族元素,A、B两元素的原子分别获得两个电子形成稳定结构时,A放出的能量大于B放出的能量;C、D两元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收的能量。若A、B和C、D分别形成化合物时,属于离子化合物可能性最大的是
A、C2A B、C2B C、D2A D、D2B
12、在已经处于化学平衡状态的体系中,如果改变某一条件,下列量发生变化,其中一定能表明平衡移动的是
A、反应混合物的浓度
B、反应的转化率
C、正、逆反应速率
D、反应混合物的压强
13、我们可以用水解度来表示盐的水解程度的大小,它是用已水解的电解质的物质的量占原来总的电解质的物质的量的百分数来表示的。若测得2L 0.1mol/L的强碱弱酸盐NaA溶液的PH值为10,则A-离子的水解度为
A、0.01% B、0.1% C、0.2% D、1%
 14、某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和氯化钠溶液,通电时,为使Cl2
被完全吸收,制得有较强杀菌能力的消毒液,设计了右图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
14、某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和氯化钠溶液,通电时,为使Cl2
被完全吸收,制得有较强杀菌能力的消毒液,设计了右图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A、a为正极,b为负极;NaClO和NaCl
B、a为负极,b为正极;NaClO和NaCl
C、a为阳极,b为阴极;HClO和NaCl
D、a为阴极,b为阳极;HClO和NaCl
15、已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合。下列关于C3N4晶体的说法正确的是
A、C3N4晶体是分子晶体
B、C3N4晶体中,C—N 键的键长比金刚石中的C—C 键的键长要长。
C、C3N4晶体中每个碳原子连接4个N 原子,而每个N原子连接3个C原子
D、C3N4晶体微粒间通过离子键结合
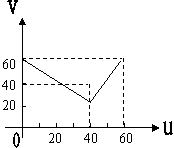 16、某气态不饱和链烃CnHm在铂催化下可以和H2作用,生成气态烃CnHm+x
。取CnHm和H2的混合气60
mL,测得反应后气体总体积随混合气中H2体积的变化而变化。反应前混合气体中H2所占的体积U和反应后气体总体积V的关系如下图所示(相同条件下的体积数),则x的值为
16、某气态不饱和链烃CnHm在铂催化下可以和H2作用,生成气态烃CnHm+x
。取CnHm和H2的混合气60
mL,测得反应后气体总体积随混合气中H2体积的变化而变化。反应前混合气体中H2所占的体积U和反应后气体总体积V的关系如下图所示(相同条件下的体积数),则x的值为
A、l B、2 C、3 D、4
17、pH=2.7的一元弱酸,加水稀释,若溶液的体积扩大10倍,
则[H+]或[OH-]变化情况是
A、[H+]增大 B、 [H+]与[OH-]都减小
C、[OH-]增大 D、 [OH-]减小
三、选择题(本题共20分)每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。
18、在20℃,某气态烃与氧气混合装入密闭容器中,点燃反应后,又恢复到20℃。此时容器内气体压强为反应前的一半,经氢氧化钠吸收后,容器内几乎真空。此烃的分子式可能是
A、CH4 B、C2H6 C、C3H8 D、C2H4
![]() 19、制造太阳能电池需要高纯度硅,工业上由粗硅制取高纯度硅常通过以下反应实现:
19、制造太阳能电池需要高纯度硅,工业上由粗硅制取高纯度硅常通过以下反应实现:
![]() ①Si(固)+ 3HCl(气)
SiHCl3(气)+ H2(气)+ 381kJ
①Si(固)+ 3HCl(气)
SiHCl3(气)+ H2(气)+ 381kJ
②SiHCl3 + H2 Si + 3HCl
关于上述条件下两个反应的叙述中错误的是
A、都是置换反应 B、反应②是放热反应
C、都是可逆反应 D、都是氧化还原反应
20、室温下,某溶液中由水电离出来的量H+和OH-浓度的乘积为10-24。在该溶液中,一定不能大量存在的离子是
A、S2O32- B、NH4+ C、NO3- D、HCO3-
21、一定条件下,在密闭容器里进行如下可逆反应:
![]() S2C12(l,橙黄色) 十
C12(g)
2SCl2(l,鲜红色)十51.16
kJ
S2C12(l,橙黄色) 十
C12(g)
2SCl2(l,鲜红色)十51.16
kJ
下列说法错误的是
A、单位时间里生成n molS2Cl2:,同时也生成n molCl2 (g),则反应达到平衡
B、达到平衡时,若升高温度,压强不变,反应混合液颜色由鲜红色变橙黄色
C、达到平衡时,单位时间里有n molS2C12消耗,同时有n molCl2(g)生成
D、其他条件不变,增加氯气,平衡向正反应方向移动,氯气的转化率增大
22、在密闭容器中充入CO2和CO的混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内的压强为P1。若控制容器的体积不变,加入足量的Na2O2,充分振荡并不断用电火花点燃至反应完全,恢复到开始时的温度,再次测得容器内的压强为P2。则P1和P2之间的关系是
A、P1=8P2 B、P1= 4P2 C、P1=2P2 D、P1=P2
第二卷(共84分)
四、(本题共27分)
23、为了防止生锈,可对铁制品表面进行“发蓝”处理:把铁制品浸入热的NaNO2、NaNO3、NaOH混合溶液中,使它的表面氧化生成一层致密的Fe3O4氧化膜(Fe3O4可以看成是Fe2O3和FeO的复合化合物),所发生的反应可以表示如下:
①3Fe + NaNO2 + 5NaOH → 3 Na2FeO2 + NH3 + H2O
② Fe + NaNO3 + NaOH + →3 Na2Fe2O4 + NH3
![]() ③Na2FeO2
+ Na2Fe2O4 +
2H2O Fe3O4
+ 4 NaOH
③Na2FeO2
+ Na2Fe2O4 +
2H2O Fe3O4
+ 4 NaOH
(1)请配平反应②的化学方程式,将结果填入题②中方框内。
(2)Na2FeO2称亚铁酸钠,Na2Fe2O4的名称是___________________。
(3)若上述热的混合液中NaOH的含量太少,则氧化膜的厚度就太薄,其原因可能是___ _________________________________________________________________________,若NaOH的含量太多,则氧化膜的厚度也太薄,其原因可能是_____________________ ______________________________________________________________________________________________________。
24、下表列出了① ~ ⑩十种元素在周期表中前四周期的位置,请回答下列问题:
|
周期序数 | ||||||||
| ⑤ | ⑥ | ⑧ | ||||||
| ① | ③ | ④ | ⑦ | ⑩ | ||||
| ② | ⑨ |
(1)在这十种元素形成的单质中化学性质最不活泼的是____________;(填具体元素的符号或化学式,下同。)金属性最强的是_______________;非金属性最强的是__________。
(2)①、③两元素的氧化物对应的水化物中碱性强的是_______________;(填具体物质的化学式,下同。)⑤、⑦两元素的最高价氧化物对应的水化物中酸性强的是________。
(3)①、②、③三元素按原子半径由小到大的顺序排列为______________________。
(4)用电子式表示②、⑨两元素形成化合物的过程____________________________。
(5)①的氧化物对应的水化物与⑦的氢化物反应的离子方程式,因物质的量配比不同产物有所不同,试分别写出有关反应的离子方程式____________________________________ _______________________________________________。
25、在一定温度下,对于难溶电解质AmBn,在水中可建立如下平衡:
![]() AmBn(s) An+(aq) + Bm-(aq)
AmBn(s) An+(aq) + Bm-(aq)
在一定温度下,当达到平衡时,[An+]m·[Bm+]n为一常数,用KSP表示,称为该温度下该难溶电解质的溶度积。
在一定温度下,当[An+]m·[Bm+]n = KSP时,溶液呈饱和状态,沉淀量既不增加,也不减少;当[An+]m·[Bm+]n > KSP时,溶液呈过饱和状态,将析出沉淀;当[An+]m·[Bm+]n < KSP时,溶液呈不饱和状态,沉淀将溶解;
试根据上述原理,计算:
(1)已知在常温下,FeS的KSP = 6.05×10-18,求此温度下FeS的溶解度______g/100g水。(设饱和溶液的密度为1 g/mL)。
(2)又已知H2S饱和溶液在常温下,[H+]与[S2— ]存在着以下关系:[H+]2·[S2— ]= 1.0×10-22。在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中[Fe2+]达到1mol/L,应调节溶液的pH为____________。
五、(本题共21分)
26、使用中学常备器材,试设计一个实验证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应。要求作出有关实验原理、过程、现象的说明。
(1)实验原理________________________________________________________________
________________________________________________________________;
(2)实验过程________________________________________________________________
________________________________________________________________;
(3)实验现象________________________________________________________________
________________________________________________________________。
27、实验室用燃烧法测定某氨基酸(CxHyNzOp)的分子组成。取m g 该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。按下图所示装置进行实验。
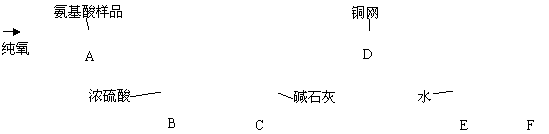
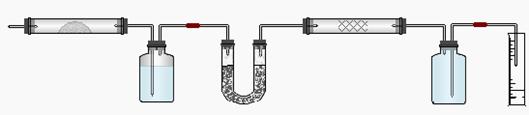
请回答下列问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是________________________
(2)以上装置中需要加热的仪器有_________________(用字母填空,下同)。操作时应先点燃_______处的酒精灯。
(3)A装置中发生反应的化学方程式是________________________________________。
(4)装置D的作用是______________________________________________________。
(5)读取N2的体积时,应注意①________________________________________;
②_______________________________________________
(6)实验中测得N2的体积为V mL(标准状况)。为确定此氨基酸的化学式,还需要的有关数据是________________________。
六、(本题共20分)。
28、化合物SOCl2是一种液态化合物,沸点为77℃。在盛有10毫升水的锥形瓶中,小心地滴加8 - 10滴SOCl2可观察到剧烈反应,液面上有白雾形成,并有刺激性气体逸出,该气体可以使沾了品红试液的滤纸褪色。
(1)根据上述实验,写出SOCl2和水反应的化学方程式________________________________,
(2)AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2跟AlCl3·6H2O混合共热,可得到无水AlCl3,其原因__________________________________________________________。
29、工业上用甲苯生产对- 羟基苯甲酸乙酯HO—![]() —COOC2H5(一种常用的化妆品防霉剂),其生产过程如下(反应条件未全部注明)所示:
—COOC2H5(一种常用的化妆品防霉剂),其生产过程如下(反应条件未全部注明)所示:
|
|
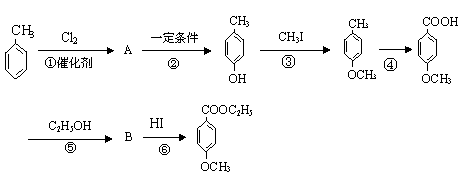

按上图填空:
(1)有机物A的结构简式为
(2)写出反应⑤的化学方程式(有机物写结构简式,注明反应条件)
(3)反应②和反应④的反应类型分别是(选填编号) 、
a.取代反应,b.加成反应,c.消去反应,d.酯化反应,e.氧化反应
(4)写出反应③的化学方程式(有机物写结构简式,不用写反应条件,但要配平)
(5)在合成线路中设计③和⑥两步反应的目的是 。
七、(本题共16分)
30.计算以下两小题时,除必须应用所有给出的数据外,还各缺少一个数据,指出该数据的名称(分别以a和b表示),并列出计算式。
(1)在温度为t℃和压力为pPa的情况下,19.5g A与11.0g B恰好完全反应,生成固体C和3.00L的D气体,计算生成C的质量(m)。缺少的数据是: 。计算式为m=
(2)0.48g金属镁与10mI盐酸反应,计算生成的H2在标准状况下的体积(V)。
缺少的数据是:
计算式为
31、现有NO2与空气的混合气体共9L,其中NO2在其中的体积分数为x,混合气体缓缓通过盛有水的洗气瓶后所得气体的体积为V(同温同压;不考虑N2O4,空气以V氮气 :V氧气 = 4:1 计算)。
(1)写出混合气体缓缓通过后发生反应的化学方程式______________________________;
(2)在混合气体中,当NO2为2 L时,反应后混合气体中氧气为_____________L,氮气为___________L;
(3)x为__________时,反应后的气体仅为氮气;
(4)试计算混合气体体积V(用x表示),并在V-x 坐标中作出相应曲线
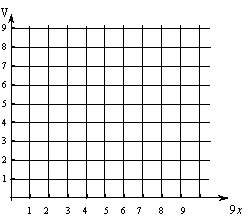 |
2006年徐汇区高三年级化学学习能力诊断题答题纸
| 流水号 | ||
(120分钟,满分150分) 2005.1
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 七 | 总分 |
| 得分 |
第一卷
本卷所需相对原子质量:H-1、He-4、S-32、Mg-24、Fe-56
一、选择题(本题共10分),每小题2分,只有一个正确选项。
| 题号 | 1 | 2 | 3 | 4 | 5 |
| 答案 |
二、选择题(本题共36分),每小题3分,只有一个正确选项。
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 答案 |
三、选择题(本题共20分)每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。
| 题号 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
第二卷
五、(本题共27分)
23、(1) Fe + NaNO3 + NaOH + → 3 Na2Fe2O4 + NH3
(2)___________________。
(3)___________________________________________________________________________ ________________________________,_______________________________________ _____________________________________。
24、(1)____________;(填具体元素的符号或化学式,下同。)_______________; __________。
(2)_______________;(填具体物质的化学式,下同。)______________。
(3)_______________________________。
(4)________________________________________________。
(5)_________________________________________________________________________。
25、(1)___________g/100g水。 (2)pH为____________。
五、(本题共21分)
26、(1)实验原理________________________________________________________________
________________________________________________________________;
(2)实验过程________________________________________________________________
________________________________________________________________;
(3)实验现象________________________________________________________________
________________________________________________________________。
27、(1)______________________________________________________________________
(2)_________________(用字母填空,下同)。操作时应先点燃_______处的酒精灯。
(3)___________________________________________________。
(4)______________________________________________________。
(5)①______________________________________________________________________;
②______________________________________________________________
(6)________________________。
六、(本题共20分)。
28、(1)_________________________________________________________________________,
(2)_______________________________________________________________________。
29、
(1)
(2)
(3) 、
(4)
(5) 。
七、(本题共16分)
30、(1)缺少的数据是: 。计算式为m=
(2)缺少的数据是:
计算式为
 31、(1)______________________________;
31、(1)______________________________;
(2)氧气为_____________L,氮气为___________L;
(3)x为__________
(4)试计算混合气体体积V(用x表示),并在V-x
坐标中作出相应曲线。
2006年徐汇区高三年级化学学习能力诊断题参考答案及评分标准
第一卷(66分)
一、选择题(本题共10分),每小题2分,只有一个正确选项。
| 题号 | 1 | 2 | 3 | 4 | 5 |
| 答案 | A | B | B | D | D |
二、选择题(本题共36分),每小题3分,只有一个正确选项。
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 答案 | D | C | C | B | C | A | B | B | B | C | D | C |
三、选择题(本题共20分)每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。
| 题号 | 18 | 19 | 20 | 21 | 22 |
| 答案 | C、D | B、C | D | A、D | A |
第二卷(84分)
五、(本题共28分)
23、(1)8、3、5、2H2O、4、3, (2分)
(2)铁酸钠; (1分)
(3)NaOH含量少,使反应①生成的Na2FeO2和反应②生成的Na2Fe2O4 量都少,致使反应③生成的Fe3O4的量也少;NaOH含量太多,使反应③的化学平衡向逆反应方向移动,Fe3O4的量减少。(2×2分)
24、(1)Ar,K,F2 (各1分)
![]()
![]()
![]() (2) NaOH ,H2SO4 (各2分) (3)K 、Na 、Mg (2分)
(2) NaOH ,H2SO4 (各2分) (3)K 、Na 、Mg (2分)
(4) + → K+[ ]- (2分)
(5) OH- + H2S → H2O + HS- ; OH- + HS- → H2O + S2-;(各2分)
(或)2OH- + H2S → 2H2O+ S2-
25、(1)2.2×10-8 g/100g水 (各3分) (2)[H+]=0.004 mol/L,pH=2.4 (各3分)
五、(本题共20分)
26、(1) 利用溶液导电性与离子浓度有关,根据溶液在不同阶段的不同导电性能,来证明溶液中自由移动离子浓度变化,从而证明该反应是离子反应。(2分)
(2) 利用测定溶液导电能力的装置,在烧杯中先加入50 mL 1mol/L(物质的量的浓度)的Ba(OH)2溶液,再一边不断地滴加1mol/L的H2SO4溶液,一边轻轻振荡。(2分)
(3) 灯泡的亮度随H2SO4溶液的不断加入,呈现由明到暗,及至熄灭,再逐渐变亮。(2分)
27、(1)避免残留在装置中的空气对实验结果产生影响。(2分)
(2)A、D;(2分) D(1分)
(3)4CxH yNzOp + (4x + y -2p)O2 → 4x CO2 + 2yH2O + 2z N2(2分)
(4) 除去未反应的O2 (2分)
(5) ①量筒水平放置在桌面 ②读数时,视线与凹液面最低点相平 (共2分,各1分)
(6)B、C两装置的增重量(共3分)
六、(本题共20分)。
28、(1) SOCl2 + H2O → SO2 + 2HCl (4分)
(2) SOCl2既耗水,生成的HCl又抑制Al3+的水解。(4分)
![]() 29、
29、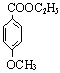 (共12分,每格2分)
(共12分,每格2分)
![]()
![]()
(1) (2) + C2H5OH + H2O
(3)a , e
(4) + CH3I → + HI
(5)防止酚羟基氧化
七、(本题共16分)
30、(1)该状况下D的密度a(g/L) (1分) m = 19.5+11-3a (g) (1分)
(2)盐酸的物质的量浓度bmol/L,(1分)
当0.01b ≥2× V(H2)= ×22.4 (L) (1分)
当0.01b ≤ 2× V(H2)= 0.01b××22.4 (L) (1分)
31、
(1)3NO2 + H2O → 2HNO3 + NO; 2NO + O2 → 2NO2 (2分)
或 4NO2 + O2 + 2H2O → 4HNO3
(2) 0.9 L 5.6L (各2分)
(3)(1分)
(4)当x = 时,反应后只剩下N2 V= 4 (L)(1分)
当0 < x < 时,氧气过量 V = 9(1-x)(1分)
 当 < x <1时,NO2过量 V = (8-3x)(1分)
当 < x <1时,NO2过量 V = (8-3x)(1分)
(图 1分)
 |