江苏省连云港市2006年高三年级最后模拟考试
化 学
本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分。考试时间120分钟。
第I卷(选择题 共74分)
一、 选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意):
1.标准状况下,m克A气体和n克B气体的分子数相同。下列说法不正确的是
A.同体积气体A和气体B的质量比为m :n
B.25℃时,1千克气体A和1千克气体B的分子数之比为n :m
C.同温同压时,气体A和气体B的密度之比为n :m
D标准状况下,等质量的气体A和气体B的体积之比为n :m
2.下列各组比较项目包含的数据关系中,前者比后者大的是
A.氨水与氯水中微粒种数 B.NH4+离子与 P4分子中的键角
C.C2H2与 C6H6分子中碳碳键键长 D.H2O2与 O2分子中氧氧键键能
3.已知白磷(P4)与CuSO4滞液反应的化学方程式为:P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4,则1molCuSO4能氧化白磷的物质的量是
A.2/5mol B.1/5mol C.11/5mol D.1/10mol
4.范德华根据真实气体与理想气体的差别,导出真实气体状态方程式:(P+an2/V2)(V-nb)=nRT,此方程中an2/V2项表示
A.气体分子占据的体积 B.气体分子对器壁的压强
C.器壁附近气体分子受内部气体的吸引力 D.气体分子的质量
5.如下图,分别在两个水槽中盛水和某液体A,再分别滴入一滴苯和水,然后用条型磁铁接近液面,并缓慢移动,水滴跟着移动,而苯滴不移动。则液体A可能为
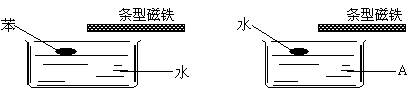
A.煤油 B. 酒精 C. 苯 D. 四氯化碳
6.对于Al与重氢氧化钠(NaOD)的水溶液反应,下列说法正确的是
A.生成的氢气中只含有D2 B.生成的氢气中含有H2、HD、D2
C.以上判断都不正确 D.生成的氢气中只含有H2
7.关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
8. 已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是 ( )
A.A、B、E一定在不同周期 B.D为第二周期
C.A、D可能在同一主族 D.C、D的单质可能化合为离子化合物
二、选择题(本题包括10小题,第9-16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.元素X的气态氢化物的分子式为H2X,这种元素的最高价氧化物的水化物的化学式可能是
A、H2XO3 B、X(OH)2 C、H2XO4 D、H6XO6
10.下列变化或数据与氢键无关的是
A 甲酸蒸气的密度在373K时为1.335g·L-1,在293K时为2.5 g·L-1
B 氨分子与水分子形成一水合氨
C 丙酮在己烷和三氟甲烷中易溶解,其中在三氟甲烷中溶解时的热效应较大
D SbH3的沸点比PH3高
11.有两种短周期元素X和Y.可组成化合物XY3,当Y的原子序数为m时,Ⅹ的原子序数为: ①m-4 ②m+4 ③m+8 ④m-2 ⑤m+6其中正确的组合是
A.①②④ B. ①②③⑤ C.①②⑤ D. ①②③④⑤
12.0.1mol/LKHSO4和0.1mol/LNa2S溶液等体积混合后,溶液能使pH试纸变蓝,则离子浓度关系正确的是
A.[SO42-] > [HS-] > [OH-] > [H+]
B.[Na+] > [K+] > [H+] > [OH-]
C.[Na+]=[S2-]+[H2S]+[HS-]+[SO42-]
D.[Na+]+[K+]+[H+]=[SO42-]+[S2-]+[HS-]+[OH-]
13.下列反应必须用稀硫酸,而不能用浓硫酸的是
A.跟锌反应制氢气 B.跟苯、浓硝酸作用制硝基苯
C.溶解金属铜 D.作乙酸乙酯水解的催化剂
14.某单质能和浓硝酸反应,若参加反应的单质与硝酸的物质的量之比为1:4,则组成该单质的元素在产物中的化合价可能是
A.+1 B.+2 C.+3 D.+4
15.电视剧《西游记》中仙境美仑美奂。这些神话仙境中所需的烟幕是用NH4NO3和Zn粉按质量比8∶6.5混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟,又知发生反应后有N2和水生成。有关的说法中正确的是
A、水起着溶解NH4NO3,发生吸热现象以启动反应的作用
B、每还原1mol NO3- 需氧化1mol Zn和1mol NH4+
C、成烟物质是两性氧化物小颗粒
![]() D、成烟物质是小锌粒,它由NH4NO3反应放热而蒸出
D、成烟物质是小锌粒,它由NH4NO3反应放热而蒸出
16、环己烷有两种立体结构,船式环己烷( )和椅式环己烷
 |
( )。 如果环己烷分子中有两个不同碳上的氢原子被氯原子取
代,考虑环己烷的船式和椅式结构,应有同分异构体( )
A、9种 B、6种 C、12种 D、18种
17.有一定质量的KNO3样品,在100C下加蒸馏水使之充分溶解,残留固体的质量为250g。该实验在400C下进行时,残留固体质量为120g,700C时为20g。已知KNO3在不同温度下的溶解度:
| 温度 | 100C | 400C | 550C | 700C |
| 溶解度 | 20g | 65g | 100g | 140g |
下列对该样品的推断正确的是
A、样品为纯净物 B、样品中混有不溶于水的杂质
C、样品中混有溶解度较大的杂质 D、当温度在550C左右时KNO3完全溶解
18.现有铷和锌组成的合金共10g,与水作用有1.12L氢气(标准状况下)放出,则合金中锌的质量分数为(提示:锌同铝一样能溶于强碱)
A、57.25% B、42.75% C、28.63% D、ABC都不正确
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共22分)
19 (10分)为节省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4溶液;直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),以巧妙的构思,“接力”的方式,设计了比较铜与锌金属活动性相对强弱的系列实验。试填写下列空白:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜、锌不接触),小心向烧杯中加入稀硫酸,观察到的现象是__________________________________________。甲同学设计思路_________________________________________________________________________________________________
(2)乙同学接着甲的实验,向烧杯中滴加__________________溶液,进而观察到的现象是________________________________,__________________________。乙同学作出锌、铜金属活动性相对强弱所依据的原理是____________________________________,____________________________________________
(3)丙同学使用直流电源和石墨电极组装电解装置,向乙同学实验后的溶液中补充了必要的试剂(作电解液)。反应在调控下开始,有关电化学反应的化学方程式为________________________ __。获得的明显实验现象____________________________________________
(4)请你再单独设计一个简单实验(试剂、仪器自选),证实锌和铜金属活动性的相对强弱(简要说明操作、现象)。__________________________________________________________
20.(12分)烟草制品燃烧时,所产生的烟雾中存在对人体健康有害的物质包括烟焦油、烟碱(如尼古丁)、CO、烟草生物碱、丙烯醛类、芳香胺、脂肪烯、酚类等一千多种有害物质。下图是检验点燃的香烟烟雾中有害成分的初步方法:
用于检验的试剂有:①乙醇,②澄清石灰水,③饱和NaOH溶液,④酸性高锰酸钾溶液,⑤浓硫酸,⑥银氨液,⑦氯化汞溶液,⑧氧化铜。
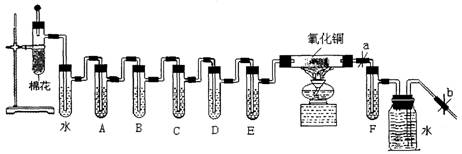 |
(1)将香烟燃烧后的产物进行吸收分析,使燃烧产物依次通过空气冷却、蒸馏水、乙醇后面的药品顺序由你排定{用序号填入空格}A ,B ,C ,D ,E ,F (尼古丁和丙烯醛成分要单独取样分析)。
(2)要使香烟点燃后继续燃烧而不熄灭,怎样操作能得到保证 :这是依据什么原理使香烟继续燃烧的?
(3)当更换第三支烟后,取出 中的略带黄色的样液5mL于试管中,后加入2mL银氨液放在水浴中加热,写出发生的银镜反应方程式 ;
(4)当燃尽第七支烟后,再取出 中的褐色样液5mL于试管,后向其中滴加数滴HgCl2溶液,产生白色溶液说明有尼古丁。
(5)通过观察硬质试管中的氧化铜颜色是否变化,来证明燃着的香烟产物中有无CO?
有人认为不行,他的理由是 。但是本实验还是能验证燃着的香烟产物中有CO产生的,是通过 置中实验现象 得以证明。
四、(本题包括2小题,共17分)
21.(8分).电荷相反的离子相互靠近时,由于相反电荷的相互作用,离子的电子云发生变化,称为极化。被异号离子极化而产生离子电子云变形的性质,称为该离子的变形性。阴阳离子都有极化作用和变形性两方面,但由于阳离子的半径小,电场集中,阴离子则相反,所以阳离子的极化作用较大,阴离子的变形性较大。一般说来,阳离子半径越小,电荷越高,极化作用越强;阴离子半径越大,负电荷越多,变形性越强。阴离子被极化后产生变形,正负电荷重心不重合,反过来又可对阳离子产生极化作用,称之为附加极化。附加极化的结果,使阴阳离子产生强烈变形,外层电子云发生重叠,键的极性减弱,键长变短,有离子键向共价键过渡,使物质的溶解度变小,热稳定性降低, 颜色加深…
含复杂阴离子的化合物中,复杂离子中的正态原子对负态原子有极化作用,化合物中的阳离子对阴离子中的负态原子也有极化作用,后一作用与前一作用方向相反,称之为反极化作用。反极化作用的存在表现为阳离子与阴离子中的正态原子共同整体争夺负性原子,使阴离子内部化学键削弱,易发生断键。
(1)BaCO3,FeCO3,ZnCO3,CaCO3分解温度由高到低的顺序是
(2)COF2,COBr2,COCl2,COI2颜色由浅到深的顺序是
(3)试解释Na2CO3的分解温度比NaHCO3高的原因。
(4)碳酸钠易溶于水,碳酸氢钠微溶于水,按理说向饱和的碳酸钠溶液中通入CO2气体应有晶体析出,流行试题就是依此编出来的,当你去做这个实验时,开始时向饱和的碳酸钠溶液中通入CO2气体却没有晶体析出为什么?
22.(9分)建于海边的镁冶炼厂,其主要原料除了海水、空气(O2)、水外,还有海边的贝壳、购入的天然气等。镁冶炼中的一些主要反应如下:
Ca(OH)2 + Mg2+ Mg(OH)2↓+ Ca2+
|
MgCl2(熔融) Mg + Cl2↑
(1)获得Ca(OH)2的反应的主要方程式是:
________________________________________________;
|
(2)在生产中,常涉及反应MgCl2·6H2O MgCl2 + 6H2O,该反应需要在HCl气氛中才能顺利完成,其理由是:
____________________________________________________。
(3)获得HCl的反应为2CH4 + O2 + 4Cl2 2CO + 8HCl(不考虑其他反应)。事实上,生产中HCl可以循环使用。试从理论上分析是否需要补弃HCl,并简要说明理由:
__________________________________
五、(本题包括2小题,共17分)
23(6分).试以有机反应为例,提供一个能够满足以下图式的反应方程式。图式中只表示了得到的主要产物。
(1)A+A→C:
(2)A+B→E:
(3)D+2A→2E:
24(11分)
眠尔通是白色结晶性粉末,学名“2-甲基-2-正丙基-1,3-丙二醇双氨基甲酸酯”。化学式C9H18N2O4。眠尔通是弱安定药,用于治疗烦躁、焦虑和神经衰弱性失眠等症,副作用少,毒性低。眠尔通合成路线如下:
A![]() B
B![]() C
C![]() D
D![]() E
E![]() F(
F(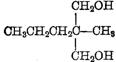 )
)![]() 眠尔通
眠尔通
1. 写出“眠尔通”的结构简式;
2. 系统命名法命名F;
3. 推断A~E各物质的结构简式;
六、(本题包括2小题,共18分)
25(8分).实验室常用KMnO4,MnO2,KClO3,Ca(ClO)2等氧化剂氧化盐酸中的Cl-来制备Cl2,氧化剂中锰元素被还原成Mn2+,氯元素被还原成氯原子,又知相同条件下还原性:Cl-<Br-<Fe2+<I-。阅读上述内容,根据下面实验数据进行有关计算。①39.2gKClO3和8.7gMnO2共热一段时间,放出4032ml气体(标准状况下);②固体中加入足量浓盐酸,充分反应,③所得气体通入过量溴化亚铁溶液中,反应完全后,测知生成1.00mol氯化铁。
(1)操作①发生反应的KClO3的物质的量为 ;
(2)操作②中放出气体的物质的量为 ;
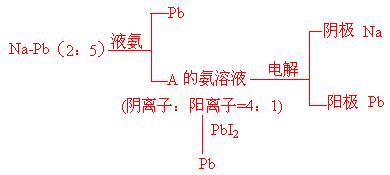
26(10分).金属钠和铅以物质的量2:5组成的合金可以部分溶于液态氨,得深绿色的溶液A,残留的固体是铅,溶液的成分和残留的成分的质量比为9.44:1。溶液A可以导电,摩尔电导率的测定实验证实,溶液A中除液氨原有的少量离子(NH4+离子和NH2-离子)外,只存在一种阳离子和一种阴离子(不考虑溶剂合离子),而且它们的个数比是4:1,阳离子只带一个电荷。通电电解时,在阳极上析出铅,在阴极上析出钠。用可溶于液氨并在液氨中电离的盐PbI2配制的PbI2液氨溶液来滴定溶液A,达到滴定终点时,溶液A的绿色褪尽,同时溶液里的铅全部以金属铅的形式析出。回答下列问题:
(1)溶液A中的电解质的化学式为 。
(2)写出上述滴定反应的离子方程式并配平。
(3)已知用于滴定的碘化铅的浓度为0.009854mol·L-1 ,达到终点时消耗碘化铅溶液20.03mL,问共析出金属铅多少克?
化学参考答案
1.C 2.B 3.D 4 C 5 D 6 B 7 C 8 B
9 CD 10 D 11 D 12 AC 13 AD 14 BD 15 BC 16 C 17 BD 18A、
19 (10分)(1)锌片表面有气泡产生。在金属活动性顺序中,锌排在氢的前面,可与稀硫酸反应,铜排在氢的后面,不与稀硫酸反应。
|
(3)2CuSO4+2H2O===2Cu+O2↑+H2SO4;阳极产生无色气体、阴极石墨表面产生红色固体。
(4)取两片相同的铁片,分别放入盛有ZnSO4溶液、CuSO4溶液的两支试管中,观察铁片表面的变化。(其它合理答案均可)
20

![]()
21
(1)ZnCO3 >FeCO3>CaCO3 >BaCO3(根据极化力大小判断)
(2)由F-到I-离子半径依次增大,变形性增强,离子相互极化作用增强,化合物的颜色按COF2,COCl2,COBr2,COI2顺序有浅到深。
(3)H+具有与Na+相同的离子电荷,但H+半径很小,可以钻入O2-电子云内部,对O2-产生极化作用,这与中心C(Ⅵ)对O2-的极化作用恰好相反,导致CO32的热稳定性降低,故NaHCO3的分解温度低于Na2CO3
(4)碳酸氢钠的溶解度在同温时比碳酸钠小,原因是碳酸氢钠分子间可以形成链状或环状的氢键,但氢键的形成需要过程,故开始时向饱和的碳酸钠溶液中通入CO2气体没有晶体析出。
22(1)CaCO3 CaO + CO2↑
CaO + H2O
Ca(OH)2
(2)抑制MgCl2(Mg2+)水解
(3)不需要补充HCl,因为Cl2 ~ 2HCl ~ Mg(OH)2 ~ MgCl2 ~ Cl2 依据Cl元素守恒可以看出理论上不需要补充HCl
23 (1)C2H5OH + C2H5OH = C2H5OC2H5+ H2O
(2)C2H5OH + CH3COOH = CH3COOC2H5 + H2O
(3)CH3COOCOCH3 +2C2H5OH = 2CH3COOC2H5 + H2O
24 1.![]() (3分)
(3分)
2.2-甲基-2-正丙基丙二醇(3分)
3.A:CH3CH2CHO
B:CH3CH2![]() -
-![]() CHO C:CH3CH2CH=
CHO C:CH3CH2CH=![]() CHO
CHO
D:CH3CH2CH2-![]() CHO E:
CHO E: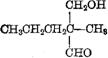 (各1分)
(各1分)
25.
(1)0.12mol
(2)0.7mol
26.
(1)Na4Pb9 (2)2Pb2++Pb94-=11Pb
(3)m(Pb)=0.00985mol.L-1×0.02003×10-3L.ml-1×11/2×207.2g.mol-1×10-3mg.g-1=0.2247g