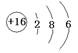2006年辽宁省沈阳市高三上化学教学质量检测监测试卷
2006.1
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟.
第Ⅰ卷(选择题 共44分)
原子量:Fe:56 Mg:24 Na:23 N:14 H:1 O:16 Al:27
一、选择题(本题包括22小题。每小题只有一个选项符合题意。)
1.下列说法摘自一些科普杂志或广告用语,你认为有科学性错误的是 ( )
A.所有养料最终只有变成溶液,才能被动植物吸收
B.酸中毒病人输液时不应采用0.9%的氯化铵溶液
C.“白雪磷”漂白粉,令所有化学物质黯然失“色”
D.硅的提纯与应用促进了半导体元件与集成芯片事业的发展
2.下列各项对氧的三种同位素16O、17O、18O的原子均不同的是 ( )
A.核电荷数 B.中子数 C.电子层数 D.元素种类
3.下列变化不属于化学变化的是 ( )
①由干冰得到二氧化碳气体
②石墨在一定条件下转化为金刚石
③烧瓶中有二氧化氮气体,加入活性炭后红棕色逐渐消失
④电解质溶液导电
A.①② B.②③ C.①③ D.①②④
4.工业上冶炼金属一般用热分解法、热还原法和电解法。由于金属的化学活动性不同因此采用的不同的冶炼方法。你认为选择的原则主要是依据 ( )
A.金属阳离子得电子的能力 B.金属熔点的高低
C.金属在自然界的存在形式 D.金属元素在地壳中的含量
5.短周期主族元素的原子中,前者一定大于后者的是 ( )
A.中子数、质子数 B.质量数、核电荷数
C.最高正化合价数、负化合价数 D.核外电子数、主族序数
6.将钠、镁、铝各0.3mol分别放入100mL 1mol/L的盐酸中,同温同压下产生气体的体积比是 ( )
A.1:2:3 B.3:1:1 C.6:3:2 D.1:1:1
7.下列各组离子在酸性溶液中可以大量共存的是 ( )
A.ClO-、Na+、Cl-、S2- B.NO3-、K+、Na+、Fe2+
C.Cu2+、K+、SO42-、NO3- D.HPO42-、Na+、ClO4-、Cl-
8.已知Co2O3在酸性溶液中易被还原成CO2+、Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是 ( )
A.3Cl2+6FeI2=2FeCl3+4FeI3 B.Cl2+2KI=2KC+I2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O D.2FeCl2+Cl2=2FeCl3
9.含20.0gNaOH的稀溶液与足量稀盐酸反应,放出28.7kJ的热量,表示该中和反应的热化学方程式正确的是 ( )
A.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l);△H=+28.7kJ/Mol
B.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l);△H=-28.7kJ/Mol
C.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l);△H=+57.4kJ/Mol
D.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l);△H=-57.4kJ/Mol
10.下列反应中,金属铜的质量不变的是 ( )
A.锌铜原电池中铜作正极 B.铜的电解精炼时纯铜作阴极
C.在镀件上电镀铜时铜作阳极 D.将铜片投入三氯化铁溶液中
11.在某些高档点心的包装盒内有个小纸袋,将小纸袋打开,可看到灰黑色粉末,其中有些已变成棕褐色。将灰黑色粉末溶于盐酸,取上层清液,滴入几滴氯水,再滴入KSCN溶液,马上出现血红色。以下结论不正确的是 ( )
A.该灰黑色粉末用作抗氧化剂 B.小袋中的原装粉末是Fe2O3
C.小袋中可能装有活性铁粉 D.该灰黑色粉末不可食用
|
①浓硫酸 ②NaOH溶液
③KI溶液 ④饱和食盐水
A.①② B.②③
C.①②③ D.①②③④
13.氯化铝溶液与氢氧化铝胶体具有的共同性质是 ( )
A.分散质粒直径小于1nm
B.光线透过时,从侧面可观察到一条光亮的通路
C.能透过半透膜
D.加热蒸干、灼烧后都有氧化铝生成
14.向固定容积的绝热密闭容器中投入一定量A、B两种气体,发生如下反应A(g)+B(g)=2C(g),完全反应后容器内压强增大,则下列说法正确的是 ( )
A.反应后混合气体总分子数增多
B.反应后混合气体的平均相对分子质量增大
C.反应物具有的总能量小于生成物具有的总能量
D.该反应为放热反映
15.下列各组数据中,其比值为2:1的是 ( )
A.常温下,pH=7的氨水与(NH4)2SO4的混合液中,c(NH4)+与c(SO4)2-之比
B.相同温度下,0.2mol/L HCOOH溶液与0.1mol/L HCOOH溶液中c(H+)之比
C.Na2CO3溶液中c(Na+)与c(CO32-)之比
D.pH=2的醋酸溶液与pH=2的H2SO4溶液的物质的量浓度之比
16.下列说法正确的是 ( )
A.通常状况下,因为水中有氢键所以比H2S稳定
B.SiO2相对分子质量比CO2大,因此SiO2熔沸点比CO2高
C.C2H2和H2O2中所含化学键类型相同
D.离子晶体在常温下不可能为固体状态
17.下列实验操作中,错误的是YCY ( )
A.测定中和热时,需使放入的小烧杯瓶口低于大烧杯瓶口
B.硫酸铜结晶水含量测定时,需连续两次称量的质量差不超过0.1g为止
C.测定未知NaOH溶液时,碱式滴定管需用未知NaOH溶液润洗2-3次
D.配制0.1mol/L硫酸溶液时,将量取的浓硫酸稀释、冷却到室温后倒入容量瓶
18.下列叙述中指定粒子数目一定大于NA的是 ( )
A.11.2L N2和NO的混合气体所含的原子数
B.12g 14C中所含的碳原子数
C.28g铁在反应中作还原剂时,失去电子的数目
D.1L0.1mol/L CH3COOH溶液中所含分子总数
19.把过量Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡
![]() Ca(OH)2(s)
Ca2+(aq)+2OH-(aq),下列说法正确的是 ( )
Ca(OH)2(s)
Ca2+(aq)+2OH-(aq),下列说法正确的是 ( )
A.恒温下向溶液中加入少量CaO固体,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入少量Na2CO3固体,溶液的pH升高
D.恒温下向溶液中加入少量CaO固体,溶液中Ca2+的物质的量不变
20.运用元素周期律分析,下列说法错误的是 ( )
A.Ra是第七周期、IIA族的元素,Ra(OH)2的碱性比Mg(OH)2的碱性强
B.As是第四周期、VA族的元素,AsH3的还原性比NH3的还原性弱
C.Cs的原子半径比Na的原子半径大,Cs与水反应比Na与水反应更剧烈
D.Cl的核电荷数比Al的核电荷数大,Cl的原子半径比Al的原子半径小
21.在隔绝空气的情况下,9.8gFe、Mg混合物溶于一定量某浓度的稀硝酸中,当金属完全溶解后,收集到0.2molNO气体,在反应后的溶液中加入足量的烧碱溶液,可生成氢氧化物沉淀的质量为YCY ( )
A.18g B.20g C.22g D.24g
22.NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的PH=2。下列对该溶液的叙述不正确的是 ( )
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol/L
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性
第Ⅱ卷(非选择题 共56分)
二、本卷共4小题,共56分。
23.(13分)A、B、C、D、E都是短周期元素,它们的核电荷数依次增大。元素A的原子核内仅有一个质子,B、C为同周期相邻元素且E与C同主族,E的质子数为C的2倍,元素D的最外层电子数比K层电子数多1,请回答下列问题
(1)填写元素符号A ;C ;D
(2)写出元素E的原子结构示意图
(3)写出由上述元素组成的具有漂白作用的三种物质的化学式
、 、
(4)由A、B、C三种元素形成的化合物的水溶液显碱性,请写出该化合物的电离方程式
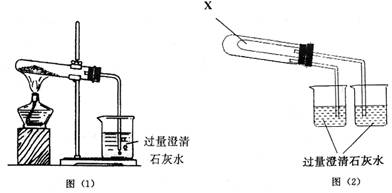
24.(13分)为验证Na2CO3和NaHCO3的热稳定性,传统的设计方案如下:将Na2CO3和NaHCO3分别放入图(1)装置的试管中,然后加热并通过观察石灰水是否变化来验证Na2CO3和NaHCO3热稳定性;某研究性学习小组对实验装置作了如下改进:即“套管实验”,其装置如图(2)所示(加热装置未画出),请观察实验装置,分析实验原理,回答下列问题
|
(1)NaHCO3受热分解的化学方程式为
(2)加热NaHCO3固体时,观察到烧杯中的现象是 ;
其离子方程式
(3)用套管实验时,X中应加入的药品为 (填Na2CO3或NaHCO3),其理由是
(4)若检查图(2)装置的气密性,可采用
|
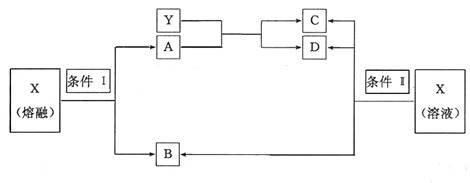
(1)已知条件I和条件II相同,则该反应条件为
(2)物质X的电子式为
(3)写出B与Ca(OH)2反应的化学方程式
(4)写出X在条件II下反应生成B、C、D的离子方程式
(5)写出实验室制B的化学方程式,并标出电子转移方向、数目
(6)请简述鉴定物质X的实验方法
![]() 26.(14分)在某温度时将2mol A和1molB两种气体通入固定容积为2L的密闭容器中,发生如下反应:2A(g)+B(g)
xC(g),2min时反应达到平衡状态,经测定B的物质的量为0.4mol,C的反应速率为0.45mol/(L·min).
26.(14分)在某温度时将2mol A和1molB两种气体通入固定容积为2L的密闭容器中,发生如下反应:2A(g)+B(g)
xC(g),2min时反应达到平衡状态,经测定B的物质的量为0.4mol,C的反应速率为0.45mol/(L·min).
(1)平衡时,C的浓度为 。
(2)x值为 。
(3)下列各项能表明该反应达到平衡的是 。
A.VA正:VB逆=2:1 B.混合气体密度不再变化
C.混合气体压强不再变化 D.A的转化率不再变化
(4)若向原平衡混合物的容器中通入a mol C,平衡时A的物质的量为 mol
(5)若向原平衡混合物的容器中通入氦气(不与A、B、C反应),化学平衡
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(6)欲使反应达到平衡时C的百分含量与原平衡相等,则起始加入的A、B、C的物质的量(用nA、nB、nC表示)之间的应该满足的关系为
参考答案及评分标准
第I卷 本卷共22小题,每小题2分,共44分
1.C 2.B 3.C 4.A 5.B 6.B 7.C 8.A 9.D 10.A 11.B 12.C
13.D 14.D 15.A 16.C 17.A 18.D 19.C 20.B 21.B 22.D
第Ⅱ卷 本卷共4小题,共34分
23.(13分)
(1)H、O、Al(每空1分,共3分)
|
(2) (2分)
(3)O3、H2O2、SO2(每空2分,共6分)
![]() (4)NH3·H2O
NH4++OH-(2分)
(4)NH3·H2O
NH4++OH-(2分)
24.(13分)
|
(1)2NaHCO3 Na2CO3+CO2↑+H2O(2分)
(2)出现白色浑浊(1分);CO2+2OH-=CaCO3↓+H2O(2分)
(3)NaHCO3(2分);说明NaHCO3能在较低温度下分解(3分)
(4)用酒精灯微热,看两个烧杯中的导管口是否都有气泡冒出(3分)
25.(16分)
(1)电解(2分)
|
(2) (2分)
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(2分)
|
(4)2Cl-+2H2O 2OH-+H2↑+Cl2↑(2分)
2e-
(5)MnO2+4HCl MnCl2+2H2O+Cl2↑(用双线桥表示也可)(4分)
(6)用焰色反应检验Na+;(2分)用硝酸银和稀硝酸检验Cl-(2分)
26.(14分)
(1)0.9mol/L(2分) (2)3(2分) (3)AD(2分)
(4)![]() +
+![]() (2分) (5)C(2分)
(2分) (5)C(2分)
(6)nA=2nB;nC≥0(2分) 或nA、nB均为0;nC>0(2分)