泰州市2006年十校联考试题
总分150分
可能用到的原子量:H:1 C:12 N:14 O:16 K:39 Mn:55
Fe:56 Cu:64 I:127
(Ⅰ卷 共60分)
一、选择题(每小题有一个选项符合题意,每小题4分,共28分)
1、重庆市天原化工厂今年4月16日发生特大氯气泄漏和三氯化氮爆炸事故,造成多人死亡和失踪。已知三氯化氮分子结构与氨相似,下列有关说法不正确的是
A、消除储气罐上空泄漏出的高浓度氯气,可喷洒碱液
B、发生氯气泄漏时,附近人员可用浸有碳酸钠溶液的毛巾捂住鼻孔进行自我保护
C、氯气能腐蚀金属及非金属材料,这种腐蚀主要属于电化腐蚀
D、三氯化氮分子是极性分子
2、生物冶金技术越来越受到科学家的重视,这项技术的关键之一是寻找 一些特殊的酶。下列有关叙述错误的![]()
![]() 是
是
A、酶是一种蛋白质 B、酶只有在强酸性或强碱性条件下才能发挥作用
C、酶的催化作用具有高效性、选择性和专一性
D.发展生物冶金技术有利于节约能源和保护环境
3、醋酸可以通过分子间氢键双聚。一定温度下,将一定质量的冰醋酸加水稀释过程
中,溶液的导电能力变化如右下图所示,有关说法正确的是
A、a、b、c三点溶液的pH:a>b>c
B、用湿润的pH试纸测量c处溶液的pH值,比实际pH值偏小
C、a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c
D、若在“O”点醋酸双聚成八元环分子,则其结构为: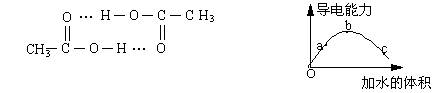
4、在下列实验中,不能达到目的的是
A、用金属钠分别与水和乙醇反应,确定水和乙醇分子中羟基氢(-OH)的活泼性强弱
B、用石墨作电极,电解Mg(NO3)2 、Cu(NO3)2 的混合溶液,确定铜和镁的金属活动性强弱
C、进行H2O和H2S 的热分解实验,确定硫和氧两种元素的非金属性强弱
D、根据Na2CO3 和Na2SO3 水溶液酸碱性强弱,确定碳和硫两元素非金属性的强弱
5、有些单质,易溶于含同一元素的盐溶液中,如:硫易溶于硫化钾溶液中,对于由①CaCO3、②KI、③Al(OH)3、④AgOH(Ag2O)、⑤I2五种物质所组成的混合物,要使其每种成分逐一溶解(一次只溶解一种物质),试剂选用顺序正确的是
A. 氨水 乙醇 水 氢氧化钾 硝酸
B.四氯化碳 水 氨水 氢氧化钠 盐酸
C.水 苯 氨水 氢氧化钾 硝酸
D.水 盐酸 氢氧化钠 氨水 乙醇
6、下列各组离子在溶液能大量共存,加入Fe2(SO4)3后仍能大量共存的是
A、Na+ I- CO32- ClO- B、Fe2+ H+ K+ NO3-
C、Ba2+ Na+ SCN- Cl- D、Cu2+ Fe2+ Cl- NO3-
7、已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是 ( )
A.A、B、E一定在不同周期 B.D为第二周期
C.A、D可能在同一主族 D.C、D的单质可能化合为离子化合物
二、选择题(每小题有1—2个选项符合题意,每小4分,共32分)
8、化学是一门实用的、中心的学科,生活中的许多问题常涉及到化学知识。它在给经济发展和群众生活带来方便的同时,也产生负面的影响。下列有关叙述不正确的是( )
A.次氯酸和臭氧都是强氧化剂,都能杀死水中的细菌。自来水常用氯气来杀菌消毒,是因为氯气杀菌消毒效果要比臭氧好,且不会残留有毒、有害物质
B.人们应用原电池原理,制作了多种电池,如干电池、充电电池、高能电池等。电池在现代生产和科学技术中发挥了重要作用,但废旧电池会对生态环境和公众健康造成危害。所以废旧电池必须回收再利用
C.明矾常用作净水剂,但人体摄入大量铝盐,易患“老年性痴呆”,所以明矾不能大量使用
D.氟氯烃为一类含有氟和氯的有机物,是制冷效果极佳的致冷剂。但它能破坏臭氧层,人们正在采取措施减少并逐步停止氟氯烃的生产和使用
9、共价键的断裂有均裂和异裂两种方式,即均裂:A∶B→A·+B·,异裂:A∶B →A++[∶B]-。下列化学反应中发生共价键均裂的是( )
A.2K+2H2O=2KOH+H2↑
B.2Na+2C2H5OH→2C2H5ONa+H2↑
C.Na2CO3+H2O![]() NaHCO3+NaOH
NaHCO3+NaOH
D.CH3COOH+C2H5OH![]() H2O+CH3COOC2H5
H2O+CH3COOC2H5
10、甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol·L-1时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol·L-1的乙酸,经测定它们的pH从大到小依次为a、乙酸、b。由此可知( )
A.a的浓度必小于乙酸的浓度 B.a的浓度必大于乙酸的浓度
C.b的浓度必小于乙酸的浓度 D.b的浓度必大于乙酸的浓度
11、将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如下:
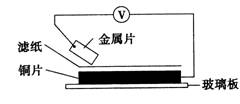 已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大。
已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大。
| 金属 | 电子流动方向 | 电压/V |
| 甲 | 甲 | +0.78 |
| 乙 | Cu | -0.15 |
| 丙 | 丙 | +1.35 |
| 丁 | 丁 | +0.30 |
请依据记录数据判断,下列有关说法正确的是( )
A.在四种金属中丙的还原性最强
B.金属乙能从硫酸铜溶液中置换出铜
C.甲、丁若形成原电池时,甲为正极
D.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀
12、某烃的衍生物A,分子式为C6H12O2。实验表明A跟氢氧化钠溶液共热生成B和C,B跟盐酸反应生成有机物D,C在铜催化和加热条件下氧化为E,其中D、E都不能发生银镜反应。由此判断A的可能结构有( )
A.6种 B.4种 C.3种 D.2种
13、下列离子方程式书写正确的是:
A.硫酸亚铁加过氧化氢溶液:Fe2+
+ H2O2 + 2H+![]() Fe3+ + 4H2O
Fe3+ + 4H2O
B.将少量硝酸银溶液滴入氨水中:Ag+
+ 2NH3·H2O![]() [Ag(NH3)2]+ + 2H2O
[Ag(NH3)2]+ + 2H2O
C.KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀
2Al3++3 SO42-+3 Ba2++6 OH-=2Al(OH)3↓ +3BaSO4↓
D铝粉与NaOH的D2O溶液反应:2Al
+ 2OH- + 2D2O![]() 2AlO2- + H2↑+2D2↑
2AlO2- + H2↑+2D2↑
14、铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
下列计算结果正确的是
A. ①中溶解了5.6gFe B.硝酸的浓度为4mol/L
C. ②中溶解了9.6gCu D.④中V=8960
15、某一元弱酸HA的相对分子质量为M。在t℃时,将a gHA完全溶解于水,得VmL饱和溶液,测得该溶液的密度为ρg·cm-3,其中n(A-)为bmol。下列叙述,错误的是
A.溶液中c(H+) =![]() B.物质的量浓度c(HA) =
B.物质的量浓度c(HA) =![]() mol·L-1
mol·L-1
C.t℃时,HA的溶解度S =![]() D.HA的质量分数w(HA) =
D.HA的质量分数w(HA) =![]()
(Ⅱ卷 共90分)
三、(本题包括2小题,共20分)
16、(8分)使用常用仪器,运用化学原理进行巧妙的设计,就可以用同一个简单的装置实现多种用途。
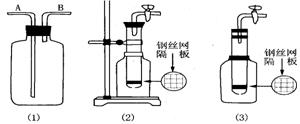
(1)利用上图中(1)装置,用两种不同的方法分别收集NO,试简述操作方法:
。 。
(2)甲同学把试管底部钻出一小洞,并和广口瓶组成下图中(2)装置,通过开、关导管上的阀门可以控制试管内的反应随时发生或随时停止。如果该装置中的隔板是用铜丝制成,则该装置可以制取的常见气体有 (填二种)。
(3)乙同学认为,可把(2)装置做如下图(3)的改动,用橡皮塞替代铁架台来固定试管。请判断乙同学的做法是否可行? 理由是 。
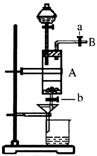 17、(12分)三氯化铁是中学化学实验室中常用的化学试剂。同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3·6H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,用分液漏斗向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3·6H2O晶体。
17、(12分)三氯化铁是中学化学实验室中常用的化学试剂。同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3·6H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,用分液漏斗向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3·6H2O晶体。
填写下列空白:
⑴滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是 。
⑵烧杯内放过量稀HNO3的原因是 ,
发生反应的离子方程式是 。
⑶整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是 。
⑷利用这个装置进行实验,你认为该实验存在的缺点可能有:
, 。(写两条即可)
⑸乙同学对该实验进行了改进,他是用空烧杯承接滤液,加入适当的试剂,然后在HCl的气流中、一定温度下蒸发、浓缩、降温结晶而得到纯净的FeCl3·6H2O,你认为加入的试剂可以是 。(填序号)
①适量氯气 ②适量过氧化氢和稀盐酸 ③酸性高锰酸钾溶液 ④氢氧化钠溶液
在HCl的气流中、一定温度下蒸发、浓缩、降温结晶的理由是 。
四、(本大题包括3小题,共32分)
18、(10分)化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热,等等.
(1)许多化学反应的反应热可以直接测量,其测量的仪器叫做________.
(2)下列DH表示物质燃烧热的是________;表示物质中和热的是________.(填![]() 、
、![]() 和
和![]() 等)
等)
A.![]() ;
;![]()
B.![]() ;
;![]()
C.![]() ;
;![]()
D.![]() ;
;![]()
E.![]() ;
;![]()
F.![]() ;
;![]()
G.![]() ;
;![]()
H.![]() ;
;![]()
(3)2.00g![]() 气体完全燃烧生成液态水和
气体完全燃烧生成液态水和![]() ,放出99.6 kJ的热量.写出该反应的热化学方程式:____ ________.
,放出99.6 kJ的热量.写出该反应的热化学方程式:____ ________.
(4)充分燃烧一定量的丁烷放出的热量大小为Q,生成的![]() 恰好与5 mol·
恰好与5 mol·![]() 100 mL KOH溶液完全反应.求燃烧1 mol丁烷放出的热量(设其数值为X)____ .
100 mL KOH溶液完全反应.求燃烧1 mol丁烷放出的热量(设其数值为X)____ .
19、(10分)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似,又已知AlCl3熔沸点较低,易升华。试回答下列问题:
(1)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式: 。
(2)Be(OH)2与Mg(OH)2可用 试剂鉴别,其离子方程式为: 。
(3)BeCl2是 化合物。(填“离子”或“共价”)
(4)Li与Mg根据对角线规则,性质也相似,则Li在空气中燃烧,主要产物的化学式是 。
20、(12分)甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图。
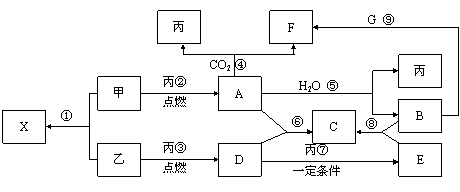
请回答:
(1) 写化学式:丙_________,E________。
(2)X的电子式为____________________。
(3) 写出A与H2O反应的化学反应方程式:__________________________ 。
(4) 写出B与G溶液反应生成F的离子方程式:________________________。
(5) 在上图的反应中,不属于氧化还原反应的是(填序号)______________。
五、(本题包括2小题,共20分)
21、(8分)烯烃通过臭氧化并经锌和水处理得到醛或酮。例如:
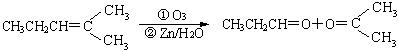
某烯烃A的化学式为C5H6,经过以下转化:
(1)A经过臭氧化并经锌和水处理得到B和C,B和C互为同系物,且B比C少1个碳原子。
(2)B和C均能发生银镜反应,将B与足量的H2在催化剂作用下可得到D;将C与银氨溶液反应后,并酸化可得到E;
(3)D和E在一定条件下反应可得到三种不同有机产物F、G、H,其中F的化学式为(C5H6O4)n,G的化学式为C5H6O4,H的化学式为C5H8O5。
则:(1)A的结构简式为 ; F的名称为 。
(2)D+E ®F的化学方程式是: 。C与银氨溶液反应的化学方程式是 。
22、(12分)2005年全世界石油价格居高不下,其主要原因是随着社会生产的发展、人口增多,对能源的需求量逐年增加,全球石油储量下降。寻求和制备代号称“黑金”的新能源已经成为紧迫任务,化学工作者正在研究以天然气和醇类合成优质汽油的方法。
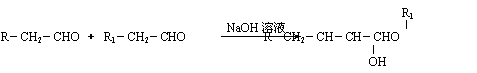 已知:⑴凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
已知:⑴凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
⑵
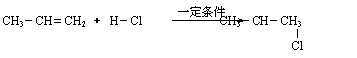 |
⑶
 合成路线如下:
合成路线如下:
⑴在反应②~⑦中,属于加成反应的是 ,属于消去反应的是 。
⑵写出下列反应方程式
E → F: ;
H → G: 。
⑶H也能与NaOH溶液反应,其反应方程式为 ,生成的有机物能否在Cu或Ag作催化剂的条件下被空气氧化 (选填“能”或“否”)。
六、(本题包括2小题,共18分)
23、(8分)相对分子质量为 400 以下的某脂肪酸 1.0 g 可与 4.6 g 碘完全加成,也可被 0.17 g KOH 完全中和,由此推断该脂肪酸的准确相对分子质量是多少?
24、(10分)下图是200 mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量 (m)随温度(t)变化的关系曲线。(已知草酸锰不稳定,但其中锰元素的化合价在300oC以 下不变)
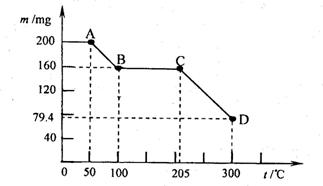
试回答下列问题:
(1)写出B点固体产物的化学式 ;
(2)从B点到c点过程中固体物质质量不变的原因是 。
(3)通过计算确定D点处产物的相对分子质量,并推断其合理的化学式。
泰州市十校联考试题参考答案
第I卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | B | D | D | B | D | B | A |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 答案 | D | A | AD | D | B | BD | C |
第II卷
16、(1)①广口瓶中盛满水,NO从B管通入;
②广口瓶中盛满CO2气体,NO从B管通人
(2)H2 CO2 H2S , ,
(3)否 由于广口瓶被橡皮塞密封后,瓶内的气压会随液体的排入而增大,使试管中的液体不能在关闭阀门时排入广口瓶中,因而不能使反应随时停止,甚至会由于容器中气压过高而发生危险。
17、答案:⑴废铁屑中的不溶性杂质与Fe在盐酸中构成原电池,加快了反应速率。
⑵将Fe2+全部氧化成Fe3+ NO3- + 4H+ + 3Fe2+ = 3Fe3+ + NO↑+ 2H2O
⑶使装置内部与外界大气相通,便于A中液体流下。
⑷产生NO气体污染环境;所得的晶体不纯。(其它合理答案亦可)
⑸②;抑制氯化铁水解,防止生成氧化铁。
18、(1)量热计
![]()
|
(3)![]() ;DH=-1294.8 kJ·
;DH=-1294.8 kJ·![]()
(4)[8Q,16Q]
19、(1)Be+2OH-==BeO22-+H2↑
(2)NaOH溶液 Be(OH)2+2OH-====BeO22-+2H2O
(3)共价
(4)Li2O
![]() 20、(1) O2 SO3 (2)
20、(1) O2 SO3 (2)
(3) 2Na2O2 + 2H2O 4NaOH + O2↑
(4) HCO3- + OH- CO32- + H2O (5) ⑧⑨
21、(1)![]() (2分) 聚丙二酸乙二酯(2分)
(2分) 聚丙二酸乙二酯(2分)
![]() (2分)
(2分)
![]()
22、⑴③⑤⑦;②④
⑵
 |
⑶ 否
23、(8分)解:首先确定该酸为几元酸及其近似相对分子质量。
设该酸为 n 元酸,则
R(COOH)n + n KOH → R(COOK)n + n H2O
Mr 56 n
1.0 g 0.17 g
Mr = 329n < 400,故 n = 1。
该酸为一元脂肪酸,其近似相对分子质量为 329。(2分)
其次确定该酸烃基中键的不饱和度
n (酸)∶n (I2)=![]() ∶
∶![]() =1∶6
(3分)
=1∶6
(3分)
故可假设脂肪酸的分子式为 CmH2m-12O2 。
最后确定该脂肪酸的准确相对分子质量
Mr ( CmH2m-12O2 ) = 329 , m = 22 。
该脂肪酸的准确相对分子质量为 12×22+1×32+16×2=328 。(3分)
24、(1)MnC2O4
(2)说明MnC2O4在100℃—205℃之间较稳定
(3)D点产物的相对分子质量为71,化学式为MnO