郑州市200年高中毕业班第三次质量检测
理综(化学部分)
可能用到的原子量: Na—23 H—1 O—16 C—12
6.郑州环保部门为了使城市生活垃圾得到合理利用,近年来逐步实现了生活垃圾分类投放的方法。其中塑料袋、废纸、旧橡胶制品等属于
A.无机物 B.氧化物 C.有机物 D.纤维素
7.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.1molNa2CO3固体中含NA个阴离子
B.0.5molAl分别与足量烧碱和盐酸反应,转移的电子数相等,均为1.5NA
C.1mol某气体的体积约为22.4L,则该气体一定处于标准状况下
D.1molCnH2n+ 2分子中含有共价键总数为(2n + 1)NA
8.下列有关说法和操作错误的是
A.进行中和热测定实验时,需要测出反应前盐酸和氢氧化钠溶液的温度以及反
应后溶液的最高温度
B.用pH试纸蘸取某待测溶液,片刻后和标准比色卡对照测其pH
C.制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生,为了增大
硫酸亚铁的溶解度,可给溶液加热到50℃~80℃,趁热过滤,然后将滤液蒸发结
晶即可
D.在烧杯中加入20 mL蒸馏水,加热至沸腾,向沸水中滴加饱和的FeCl3溶液
1~2mL。待溶液呈红褐色后,停止加热。即制得Fe(OH)3胶体
9.下列各组物质,只用一种试剂加以区别的是
①四种黑色固体:FeO、Fe、CuO、C
②四种白色粉末:(NH4)2SO4、NH4Cl、Na2SO4 、NaCl
③四种无色气体:氢气、氯化氢、二氧化硫、二氧化碳
④四种有机物:苯、四氯化碳、己烯、无水乙醇
A.只有①② B.只有③④ C.只有①②④ D.全部
10.限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐两两相互反应,符合离子方程式2H+ +SO32- == H2O + SO2↑ 的化学方程式的个数有
A. 4 B.6 C.8 D.12
11.下列物质结构或性质的叙述错误的是
A.由极性键形成的分子不一定是极性分子
B.水是一种很稳定的化合物,这是由于水分子间氢键所造成的
C.金刚石、氯化钠、金属钠、干冰四种晶体的熔点依次降低
D.HF、HCl、HBr、HI的稳定性依次减弱
12.常温时,纯水中c(H+)=a;0.1mol/L 的H2SO4与0.1mol/L的NaOH溶液等体
积混合后,由水电离出的c(H+)=b;pH=4.7的CH3COOH和CH3COONa的混合溶
液,由水电离出的c(H+)=c。则a、b、c的关系正确的是
A.a=b>c B.a>c>b
C.b>a>c D.c>a>b
![]() 13、质量分数为a的某物质的溶液mg,溶质的相对分子质量为M,与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水,得到的溶液每毫升质量为qg(无晶体析出),则下列关系错误的是
13、质量分数为a的某物质的溶液mg,溶质的相对分子质量为M,与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水,得到的溶液每毫升质量为qg(无晶体析出),则下列关系错误的是
①所得溶液的体积为:
![]()
②所得溶液的溶质的质量分数为:
![]()
③所得溶液的物质的量浓度为:
A.①③ B.①② C.②③ D.①②③
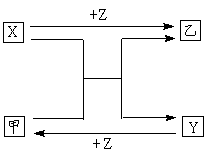 26.(14分)X、Y、Z是中学化学中三种常见元素的单质,甲、乙是两种常见的化合物,互相间有如图所示的转化关系。
26.(14分)X、Y、Z是中学化学中三种常见元素的单质,甲、乙是两种常见的化合物,互相间有如图所示的转化关系。
回答下列问题:
(1)若X为常温下气态非金属单质,甲为黑
色粉末,X能使灼热的甲变为红色Y,则X与甲反应的化学方程式为 ,
乙的电子式为
(2)若X为金属单质,Y为固体非金属单质,
则甲属于 (填“极性”或“非极性”)分子,此反应的实验现象为 。
(3)若X、Y、Z均为金属单质,甲为黑色有磁性的晶体,则X与甲反应的
化学方程式为 ,每生成3mol的Y转移的电子为 mol。
27(17分)、2005年10月5日瑞典皇家科学院颁发了诺贝尔化学奖,授予美法三位科学,他们发现了烯烃里的碳碳双键会被拆散、重组,形成新分子,这种过程被命名为烯烃复分解反应 。烯烃复分解反应如下图所示:
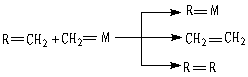
(1)某烯烃A分子式C9H10,它和金属卡宾(CH2=M)发生烯烃复分解
![]()
![]()
反应的一种产物为
则A的结构简式为 ,写出A与金属卡宾(CH2=M)发生烯烃复分解反应后,产物中属于烯烃类的结构简式(除A外) 。
(
| |
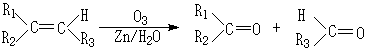
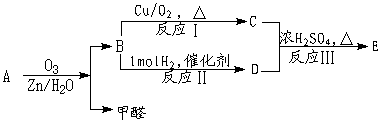

其中E的分子式为C16H16O2 。根据上述信息,回答下列问题:
①写出E的结构简式:
E
写出下列反应类型:反应Ⅱ 反应Ⅲ
②写出B和新制Cu(OH)2发生反应的化学方程式:
③C有多种同分异构体,写出苯环上无甲基且属于酯类的任意两种同分异构体:
。
28.(18分)有一包含有碳酸钠杂质的碳酸氢钠样品。为了测定其纯度,某校课外学习小组在实验室做如下实验:
(1)第一组同学称取样品m g置于坩埚中加热至恒重,根据质量减少来计算其纯度。
①为完成测定,以下图示中还缺少的仪器名称是_ .

![]()
![]()
![]()
![]()
![]()
②为了减小实验误差,在加热至恒重的过程中应如何操作?
③若坩埚质量为m0,恒重后坩埚和残留物质量为m2g,则计算碳酸氢钠样品纯度的计算式为w(NaHCO3)% = ×100% 。
(2)第二组同学称取样品m g,设计了如下图所示的装置:
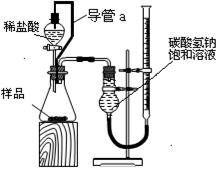
①装置中导管a的作用是 。
②实验结束时,该组同学在测量实验中生成气体体积时应注意哪些问题?
③第二组同学在实验中准确测得3个数据:实验前样品的质量m g,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL,由此欲计算碳酸氢钠样品纯度时发现少了一个必须的物理量是 。
(3)分析上述两组实验方案,你认为哪组实验方案的误差会小些?为什么?
(4)请你设计一种除上述实验原理以外的方案,写出反应方程式并简述实验步骤。
29.(11分)在一定温度、一定压强和有催化剂存在的条件下,向密闭容器
中充入1molSO2和0.5molO2,此时容器体积为100mL,发生可逆反应
2SO2(g)+ O2 (g)![]() 2SO3(g);△H<0。在恒温恒压下反应达平衡,SO3
2SO3(g);△H<0。在恒温恒压下反应达平衡,SO3
体积分数为91%。
(1)若保持其他条件不变,升高温度时,正、逆反应速率的关系为:
v(正) v(逆)(填“大于”“等于”“小于”)
(2)若保持温度和压强不变,充入1molSO3,则平衡时SO2的体积分数为
;
(3)若保持温度和压强不变,起始时充入SO2、O2、SO3的物质的量分别为amol、bmol、cmol,欲使反应达平衡时SO3的体积分数仍为91%,则a、b、c应满足的关系是 ;
(4)若保持温度不变,保持体积为50mL恒定不变,充入nmolSO2和n/2molO2,反应达平衡时,SO3体积分数仍为91%。则n= mol(结果保留2位小数)。
化学参考答案
6.C 7.B 8.B 9.C 10.A 11.B 12.B 13.D
![]()
![]() 26.(14分)
26.(14分)
(1)(3分) (2分)
(2) 非极性 (2分) 剧烈燃烧;有白烟产生,同时生成黑色固体。(2分)
(3)8Al +3Fe3O4![]() 4Al2O3
+ 9Fe
(3分) 8 mol
(2分)
4Al2O3
+ 9Fe
(3分) 8 mol
(2分)
27.(17分)
![]() (1)(每空2分共6分)
(1)(每空2分共6分)
A:
![]()
![]()
(2)
![]() ①
E:
(2分)
①
E:
(2分)
加成(还原) 酯化(取代) (每空1分,共2分)
②(3分)
![]()
![]()
![]() ③
③![]()
(任写两个即可,各2分,共4分)
28.(18分)
(1)①坩埚钳 、干燥器 (2分)
②加热后,放干燥器中冷却至室温后称量。重复操作,直到两次称量的质量差小于0.1g. (2分)
![]()
③
(2分)
(2)①使分液漏斗内气体压强与锥形瓶内气体压强相等,使分液漏斗中的稀盐酸能顺利滴下(1分);滴入锥形瓶的稀盐酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀盐酸引起的二氧化碳气体体积误差(1分)。
②待实验装置冷却后,上下移动量筒,使其中液面与广口瓶中液面相平(1分);再将视线与量筒内水的凹液面最低处相平来读取液体体积,即得到氢气在该状况时的体积(1分)。
③ 该条件时的气体摩尔体积。(1分)
(3)第二组较好(1分)。实验系统中样品损耗几率低、反应转化率高(1分);用精密测量仪器测定的数据误差较小(1分)。
(4) 如沉淀法 BaCl2 + Na2CO3 === BaCO3↓+ 2NaCl
步骤:取样、溶解、沉淀、过滤、洗涤、干燥、称量、计算。(4分)
(其他合理方法也可,如滴定法等)
29.(11分)
(1) 小于 (2分)
(2) 6% (3分)
(3) a : b = 2 : 1, c≥0 或a = b =0, c>0 (4分)
(4) 0.73 (2分)