江苏省白蒲高级中学高三化学阶段试题一(2006.9.23)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共150分。考试时间120分钟。
可能用到的相对原子质量: H-1 Li一7 C一12 N一14 O一16 Na一23
I一127 A1-27 S-32 C1-35.5 K-39 Ca一40 Fe-56 Cu-64 Zn-65
第Ⅰ卷(选择题 共64分)
一、选择题(本题包括8小题,每小题只有一个选项符合题意,每小题4分,共32分)
1.下列关于化合物的说法正确的是 ( )
A 只含有共价键的物质一定是共价化合物
B 由两种原子组成的纯净物一定是化合物
C 熔化时不导电的化合物一定是共价化合物
D 不含非极性共价键的分子晶体一定是共价化合物
2.实验室需用480毫升0.1摩升的硫酸铜溶液,现选取500毫升容量瓶进行配制,以下操作正确的是
A 称取7.68克硫酸铜,加入500毫升水 B 称取12.0克胆矾配成500毫升溶液
C 称取8.0克硫酸铜,加入500毫升水 D 称取12.5克胆矾配成500毫升溶液
3.在恒温恒容的密闭容器里发生可逆反应:2A(气)+B(气)![]() 2C(气)。容器内开始加入下列各组物质,达到平衡时逆反应速率最小的是
2C(气)。容器内开始加入下列各组物质,达到平衡时逆反应速率最小的是
A.2molA和1molB B.1molA和1molB
C.1molA和2molB D.1molB和1molC
4.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学
键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P—P 198KJ·mol—1、P—O 360kJ·mol—1、氧气分子内氧原子间的键能为
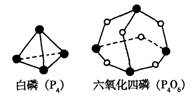 498kJ·mol—1则P4+3O2==P4O6的反应热△H为
498kJ·mol—1则P4+3O2==P4O6的反应热△H为
A.+1638 kJ·mol—1 B.一1638 kJ·mol—1
C.一126 kJ·mol—1 D.十126 kJ·mol—1
5.已知当物质的量浓度相同时,碳酸中c(CO32-)比偏铝酸中c(AlO2-)大得多,则下列推论中正确的是
A. 通入适量CO2于AlO2-溶液中,有CO32-生成
B. 含CO32-的溶液容易使Al(OH)3溶解变成AlO2-
C. HCO3-只能与Al3+反应而不能和AlO2-反应
D. NH4+、AlO2-和HCO3-能大量共存于同一溶液中
6.干燥剂的干燥性能可用干燥效率(1m3空气中实际余留水蒸气的质量)来衡量。某些干燥剂的干燥效率数据如下:
| 物 质 | 干燥效率 | 物 质 | 干燥效率 |
| MgO | 0.008 | ZnCl2 | 0.8 |
| CaO | 0.2 | ZnBr2 | 1.1 |
分析以上数据,下列有关叙述错误的是
A.MgO的干燥性能比CaO好
B.干燥效率可能与干燥剂的阴、阳离子的半径大小有关
C.MgCl2可能是比CaCl2更好的干燥剂
D.上述干燥剂中阳离子对干燥剂性能的影响比阴离子小
7.下列说法或表示正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由单质A转化为单质B是一个吸热过程,由于可知单质B比单质A稳定
C.稀溶液中:H+(aq)+OH-(aq) ![]() H2O(l); △H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ
H2O(l); △H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ
D.在101kPa时,H2燃烧的热化学方程式为:2H2(g)+O2(g) = 2H2O(l);
△H=-571.6kJ/mol,则H2在101kPa时的燃烧热为571.6kJ/mol
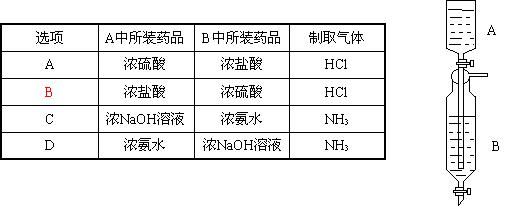 8.Inorganic Syntheses一书中,有一如图所示的装置,用以制备少量某种干燥的纯净气体。该装置中所装的药品正确的是
8.Inorganic Syntheses一书中,有一如图所示的装置,用以制备少量某种干燥的纯净气体。该装置中所装的药品正确的是
二、选择题(本题包括8小题,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9、科学家研制出多种新型杀虫剂,以代替DDT,化合物A是其中一种。下列关于这种化合物的说法正确的是
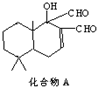 A.化合物A的化学式为C15H22O3
A.化合物A的化学式为C15H22O3
B.化合物A是芳香族化合物
C.化合物A可以发生卤代反应、酯化反应和银镜反应
D.1mol化合物A最多可与1molH2发生加成反应
10.假定把12C的相对原子质量定为24,把24g12C含有的原子个数定为阿伏加德罗常数,而物质的量的概念不变。则下列推断不正确的是
A.此时16O的相对原子质量为32
B.标准状况下,44gCO2的体积为11.2L
C.40gNaOH溶于水配成1L溶液,其物质的量浓度为1mol·L-1
D.44gCO2和28gCO含有相同数目的分子
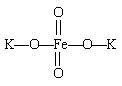 |
11.高铁酸钾 (K2FeO4)是一种新型、高效、多功能水处理剂,
是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中湿法制备的主要反应方程为:2Fe(OH)3+3ClO—+4OH—===2FeO42—+3Cl—+5H2O
干法制备的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法不正确的是
A.高铁酸钾中铁显+3价 B .湿法中每生成1 mol Na2FeO4转移3 mol电子
C.干法中每生成1 mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质
12.几种短周期元素的原子半径及主要化合价见下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是
A.L、M的单质与稀盐酸反应速率L>M B.M与T形成的化合物有两性
C.Q、T两元素的氢化物分子间存在氢键 D.L、Q形成的简单离子核外电子数相等
13.在合成氨反应中,开始充入a mol N2和b mol H2,在一定条件下,反应达到平衡,测得NH3占混合气体的25%,则平衡时N2的转化率是
A、![]() B、0.1(a+b) C、33.3% D、
B、0.1(a+b) C、33.3% D、![]()
14.下列离子方程式中正确的是 ( )
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全
|
B.用惰性电极电解MgCl2溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑
C.三氯化铝溶液跟过量氨水反应:Al3++3NH3·H2O Al (OH)3↓+3NH4+
D.铜片投入稀HNO3溶液:Cu + NO3-+ 4H+ = Cu2+ + 2H2O + NO↑
15.X元素的原子的最外层电子数与次外层电子数的差值等于电子层数。Y元素最外层电子比X元素的最外层电子多2个,则X与Y形成的化合物为
A、X3Y2 B、X2Y C、XY2 D、XY3
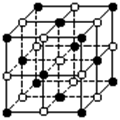 16.KO2的晶体结构与NaCl相似,可以看作是Na+的位置用K+代替,Cl -的位置用O2
- 代替,下列对KO2晶体结构的描述正确的是
16.KO2的晶体结构与NaCl相似,可以看作是Na+的位置用K+代替,Cl -的位置用O2
- 代替,下列对KO2晶体结构的描述正确的是
A.和K+距离相同且最近的O2 -共有8个
B.和K+距离相同且最近的K+共有12个
C.和K+距离相同且最近的O2 –构成的多面体是正八面体
D.和K+距离相同且最近的O2 –构成的多面体是正六面体
第Ⅱ卷(非选择题 共86分)
三、(本题包括2小题 共18分)
17.(6分)下列是某学习小组的同学关于某无色溶液中所含离子鉴别的实验设计方案。请指出存在问题的实验方案,并说明理由(有几组写几组,不一定填满,多写倒扣分)。
A.加入KSCN溶液后,溶液不显红色,再加几滴氯水,溶液颜色变为红色。说明原溶液中含Fe2+
B.加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸后,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有CO32-
E.加入浓NaOH溶液并加热,产生使湿润红色石蕊试纸变蓝的气体,说明溶液中含NH4+
(1) (2) (3)
18.(12分)某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了NaNO3、Cu(NO3)2、AgNO3。(加热及夹持装置未画出)
(1) 甲同学加热的是NaNO3。加热时发现:装置②中有能使带火星的木条复燃的气体产生;并已知参加反应的NaNO3和生成气体的物质的量之比为2:1。请写出NaNO3受热分解后另一产物的化学式 ;
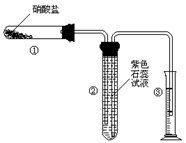 (2) 乙同学加热的是Cu(NO3)2。加热过程发现:装
(2) 乙同学加热的是Cu(NO3)2。加热过程发现:装
置②中也有气泡产生,但在上升的过程中完全消失。
装置①中的固体逐渐变为黑色。请写出Cu(NO3)2
受热分解的化学方程式: ;实
验过程中还应看到的现象为 。
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,剩余的气体也能使带火星的木条复燃,装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
(Ⅰ)4AgNO3![]() 2Ag2O+4NO2↑+O2↑ (Ⅱ) 2AgNO3
2Ag2O+4NO2↑+O2↑ (Ⅱ) 2AgNO3![]() 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
请你分析,可能正确的是哪一个并说明理由: ;
请你设计一个简单的实验证明你的结论是正确的: ;
(4)由上述3个实验的结果,请你归纳出有关硝酸盐分解的一个结论。你的结论是 。
四、(本题包括2小题 共22分)
19.(12分)某化学反应2A![]() B+D在四种不同条件下进行B、D起始浓度为零,反应物A的浓度(mol/L),随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行B、D起始浓度为零,反应物A的浓度(mol/L),随反应时间(min)的变化情况如下表:
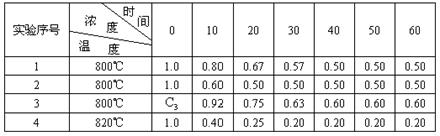
根据上述数据,完成下列填空:
(1)实验1,反应在10至20分钟时间内平均速率为____ __ ,
实验2中还隐含的条件可能是________________ ____;
(2)设反应速率实验3为![]() ,实验1为
,实验1为![]() ,若相同时间内
,若相同时间内![]() >
>![]() ,则c3___1.0mol/L(填>、=、<
,则c3___1.0mol/L(填>、=、<![]() ,理由是____________________
_____;
,理由是____________________
_____;
(3)该反应是________反应(选填吸热、放热),理由是_________________________.
20.(10分)在一个固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+B(g) ![]() 2C(g)。已知加入1 mol
A和2 mol B且达到平衡后,生成了a mol C,此时C在平衡混合气体中的物质的量分数为a。在相同实验条件下,回答下列问题:
2C(g)。已知加入1 mol
A和2 mol B且达到平衡后,生成了a mol C,此时C在平衡混合气体中的物质的量分数为a。在相同实验条件下,回答下列问题:
(1) 若往同一容器中加入2 mol A、4 mol B,达到平衡后,C的物质的量为 ______ mol,此时C在平衡混合气中的物质的量分数将________a(填大于、小于或等于)。
(2) 若往同一容器中加入了0.5 mol C,若要求平衡后C的物质的量为0.5a mol,平衡后C的物质的量分数仍为a,则还应往容器中加入什么物质,其物质的量是多少(注意:不再加入C)?_____ _______
(3) 若往同一容器中加入2 mol A、6 mol B,若要求平衡后C的物质的量分数仍为a,则应加入C __________ mol,平衡后C的物质的量为 ___________ mol。
五.(本题包括2小题,共12分)
21. (12分)元素周期表是学习化学的重要工具,它包含了许多的信息和规律。下表是元素周期表的一部分,请从下表①~⑩十种元素中选择适当的元素回答下列问题:
| 族 周期 | I A | II A | III A | IV A | V A | VI A | VII A |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)表中元素形成的四核10电子阳离子的化学式为 ,形成的四核18电子分子的化学式为_____。
(2)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质,写出元素③的氢氧化物与NaOH溶液反应的离子方程式___ _ ___。与元素⑦的性质相似的不同族元素是________(填元素符号)。
(3)某元素原子的次外层为2个电子,其最高正价与最低负价的代数和为2,则该元素的名称是____。另有一元素,其原子的核外电子数等于电子层数。这两种元素可以形成多种化合物,其中有一种离子化合物A中两元素的原子个数比为1:5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构。写出A的电子式 。A物质与水反应生成一种碱和无色气体,写出有关的化学方程式 ,该反应中的还原剂为 。
(4)物质熔沸点的高低与该物质的晶体结构有关。④的单质晶体熔点为2573K,沸点2823K,硬度大,则属于 晶体。某同学猜想⑧和⑩形成的化合物B晶体类型与NaCl相同,则B的熔沸点应 (填“高于”或“低于”)NaCl。如果用实验证明上述猜想不正确,你的实验方案是
。
六、(本题包括2小题 共20分)
22.(10分)A为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g·mol – 1,甲元素的原子最外层电子数与K层电子数相等,E的水溶液显碱性,K为乙元素的单质。C为单质,其原子在周期表中半径最小。D为气体,对空气的相对密度为1.103。在适当的条件下,它们相互之间有如下图所示的转化关系:
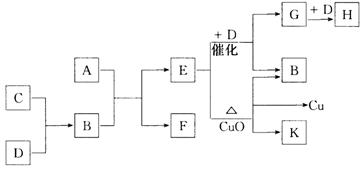
试填写下列空白:
(1)甲元素的单质在空气中燃烧出得到A外,还可得到__________________,物质F的电子式为 。
(2)反应“E + D→G + B”在 工业中的重要反应之一,“E + CuO”的化学方程式为:______________________________。
(3)C和D还能在一定条件下反应生成另一种化合物I,I与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为 。
23.(10分)A、B都是芳香族化合物。1 mol A和1 mol某一元羧酸发生酯化反应生成B。B能在一定条件下发生银镜反应而A不能;A、B的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O;A中氧元素的质量分数为31.6%,B的溶液有酸性但不能和FeCl3溶液发生显色反应。
(1)A、B相对分子质量的差值为______________________________________________。
(2)一个A的分子中应有________个(选填2、3、4)氧原子,作出此判断的理由是:_______ ___________________________________________________________________________________________________________。A的分子式是:____________。
(3)B的同分异构体甚多。其中不属于酚类且l mol能与4 mol NaOH反应的同分异构体的结构简式为:______________________________________(任写一种)。
七、(本题包括2小题 共14 分)
24.(4分)现有1mol·L—1 H2SO4和0.5mol·L—1 Na2SO4混合液200mL,要使H2SO4和Na2SO4的物质的量浓度分别变为2mol·L—1和0.2mol·L—1,应加入55.8%的H2SO4溶液(密度为1.35g·cm—3)多少毫升后,再加水配制?
25.(10分)将3.20g Cu溶于amol·L-1过量的硝酸溶液30.0mL中,假设硝酸的还原产物只有NO2和NO,反应结束后,将所剩余溶液加水稀释至1000mL,测得c(NO3―)为0.200mol·L-1。求:
(1)稀释后溶液的pH。
(2)生成的气体中NO2和NO的物质的量(用含“a”的关系式表示)。
(3)用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O NO2+NO+2NaOH=2NaNO2+H2O
若生成的混合气体能被NaOH溶液完全吸收,试讨论a的取值范围。
江苏省白蒲高级中学高三化学阶段试题一
参考答案及评分标准
1 C 2 D 3 B 4 B 5 A 6 D 7 C 8 B 9 AC
10 BC 11 AC 12 AB 13 D 14 C 15 CD 16 B C
17.(6分)(1)B 白色沉淀也可能是氯化银 (3分)
(2)D 具有这一实验现象的也可能是亚硫酸根等离子 (3分)
(多写一个倒扣2分,但不出现负分)
18.(12分)(1)NaNO2
(2)2Cu(NO3)3 ![]() 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
石蕊试液逐渐变为红色,液体几乎不被压至装置③中
(3)Ⅱ正确,如果Ⅰ正确,则装置②中气泡应全部消失,不会有液体被压至装置③中;
向装置①中的残留固体加入少量浓硝酸,产生红棕色气体
(4)硝酸盐受热分解的产物与硝酸盐中金属的活泼性有关等 (每空2分)
19.(12分)(1)0.013 mol·![]() 实验过程中使用了催化剂
实验过程中使用了催化剂
(2)> 浓度越大,反应速率越快
(3)吸热 温度升高时,平衡向右移动 (每空2分
20. (1) 2a;等于 (2) A 0.25 mol;B 0.75 mol (3) 4;4a
21.(12分)![]() (1)H3+O H2O2
(2)Be(OH)2+2OH-=BeO22-+2H2O Li
(1)H3+O H2O2
(2)Be(OH)2+2OH-=BeO22-+2H2O Li
(3)氮 [H: N :H]+[:H]- NH4H+H2O = NH3·H2O+H2↑ NH4H
(4)原子 高于 测定熔融状态下该物质的导电性,如果不导电,说明是共价化合物,与NaCl晶体类型不同(其他合理答案同样给分,本格2分,其余每格1分)
22.(1)MgO、C ![]() (每空2分,共4分)
(每空2分,共4分)
(2)硝酸 (2分)
2NH3 + 3CuO![]() 3Cu + 3H2O + N2(2分)
3Cu + 3H2O + N2(2分)
(3)H2O2+SO2=2H++SO42-(2分)
23(1)28,(2分) (2)3(2分),A中至少有一个-OH和一个-COOH;但若氧原子数大于等于4,则M(A)>200(2分),C8H8O3,⑶![]() (2分)(合理答案即给分)
(2分)(合理答案即给分)
24.104.1mL(6分)
25.⑴n(Cu)=![]() =0.05mol
=0.05mol
c(Cu2+)=0.05mol·L-1
根据电荷守恒:c(NO3―)=2c(Cu2+)+c(H+)
c(H+)=c(NO3―)-2c(Cu2+)=0.200mol·L-1-2×0.05mol·L-1=0.1mol·L-1
pH=-lg0.1=1(2分)
⑵根据物料守恒:n(NO2)+n(NO)+n(NO3―)=0.03a
根据电子守恒:n(NO2)+3n(NO)=0.05mol×2
n(NO2)=(0.045a-0.350)mol (2分)
n(NO)=(0.150-0.015a)mol (2分)
⑶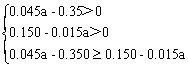
8.3≤a<10 (2分)