2005—2006高三化学阶段性考试试卷 2006.1
第I卷(选择题,共74分)
可能用到的原子量:H —1 N —14 O— 16 Na---23 K—39 C—12 Fe---56 Cu-----64 Mg—24 Al---27 Zn--65
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1、NA为阿伏加德罗常数,下列说法正确的是
A、10g甲烷所含有的电子数目为10NA
B、常温常压下,4g氦气所含有的中子数目为4NA
C、标准状况下,22.4L单质溴所含有的原子数目为2NA
D、电解食盐水若产生2g氢气,则转移的电子数目为2NA
2、 CCTV《科技博览》报道,2004年3月中科院首创用CO2合成可降解塑料聚二氧化碳。下列相关说法合理的是
A.聚二氧化碳塑料是通过加聚反应制得的
B.聚二氧化碳塑料与干冰互为同素异形体
C.聚二氧化碳塑料与干冰都属于纯净物
D.聚二氧化碳塑料的使用会产生白色污染
3、金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+
A 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B 电解过程中,阳极质量的减少与阴极质量的增加相等
C 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D 电解后,电解槽底部的阳极泥中只有Cu和Pt
4、 列各组离子一定能大量共存的是
A、含有大量Fe3+的溶液中:NH4+、Na+、CI-、SCN-
B、在强碱溶液中:Na+、K+、AlO2-、CO32-
C、在c(H+)=10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D、在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
5、 在25℃101 kPa下,白磷(化学式为P4)、红磷(化学式为P)、燃烧的热化学方程式分别为:P4(s)+5O2(g)= P4O10(s);△H = -3093.2 kJ/mol
4P(s)+5O2(g)= P4O10(s);△H = -2954.0 kJ/mol 由此判断,下列说法正确的是
A、由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
B、由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低
C、由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
D、由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低
6、 下列有关pH变化的判断中,正确的是
A 随着温度的升高,碳酸钠溶液的pH减小
B 随着温度的升高,纯水的pH增大
C 新氯水制经光照一段时间后,pH减小
D 氢氧化钠溶液久置于空气中,pH增大
7.下列说法正确的是
A 含有相同氧原子数的SO2和CO的质量相等
B 等物质的量浓度的NaOH溶液与氨水中的c(OH-) 相等
C 乙酸分子与甲酸甲酯分子中的共价健数相等
D 等温等压下,3mol C2H2(g)和1mol C6H6(g)的密度相等
8.已知富勒烯可与足量的氟气加成生成C70F70,可推测其分子结构中含有碳碳单键的数目
A 30 B 35 C 70 D 105
二、选择题(本大题包括10小题,第9-16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9、某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是 ( )
| 50ml盐酸 | 50ml盐酸 | 50ml盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
|
| 2.24L | 3.36L | 3.36L |
A.盐酸的物质的量浓度为3.0mol·L-1
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应
10、可用于鉴别以下三种化合物的一组试剂是
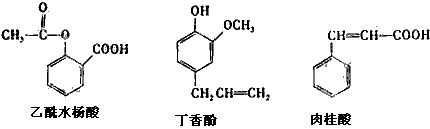
①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液
A ②与③ B ③与④ C ①与④ D ①与②
11、下列实验操作或事故处理中,正确的做法是
A 银镜反应实验后附有银的试管,可用稀H2SO4清洗
B 在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
C 为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后硝酸钡溶液
D 在250mL 烧杯中,加入216mL水和24gNaOH固体,配制10%NaOH溶液
12、物质发生化学变化时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是
A.①②③⑤ B.①②⑤
C.②⑤⑥ D.①④⑤⑥
13、下列叙述正确的是
A、反应Na2O2+2HCl=2NaCl+H2O2为氧化还原反应
B、反应:
![]() 仅涉及消去反应类型
仅涉及消去反应类型
C、10mL
0.02 mol/L AgNO3溶液与10mL
0.02 mol/L HCl溶液混合后,溶液的pH=2(设溶液总体积不变)
D、10mL
0.04 mol/L HCl溶液与10mL 0.02 mol/L Na2CO3溶液混合后,溶液的pH=7(设溶液总体积不变)
14、对于平衡体系:mA(g)+nB(g) ![]() pC(g)+qD(g)(正反应放热),有下列判断,其中正确的是
pC(g)+qD(g)(正反应放热),有下列判断,其中正确的是
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.58倍,则m+n<p+q
B.若反应从正反应开始,达平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m : n
C.若平衡体系中共有气体amol,再向其中加入bmolB,当重新达到平衡时,气体的总物质的量等于(a+b),则m+n=p+q
D.若m+n=p+q,则当容器内温度升高时,平衡逆向移动,但容器中气体的压强不变。
15、下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
A NaHSO4和Ba(OH)2 B Na2CO3和HCl
C NaAlO2和H2SO4 D Al2 (SO4)3和NaHCO3
16、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B、充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O
C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D、放电时正极附近溶液的碱性增强
17、在FeCl3和AlCl3的混合液中,先加入过量的NaI溶液,再加入足量的Na2S溶液,则所得的沉淀是
A、Al2S3
和 I2
B、Fe(OH)2 和 Al(OH)3
C、Fe2S3
和I2
D、 FeS 、 S、
Al(OH)3
18、14、将7.8
gMg Al合金溶于120ml 4mol/L H2SO4中,当合金完全溶解后,再加入120 ml 8mol/L的NaOH溶液,得到沉淀的质量为21.4g,则加入H2SO4时产生的氢气的物质的量为
A、0.4
mol B、0.6mol
C、0.8mol D、1.0mol
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
二、选择题
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷 (非选择题共76分)
三、(本题包括2小题,共23分)
19、(14分)
(1)(3分)下列有关实验的叙述,正确的是(填序号)
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)用渗析法分离淀粉中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)用酸式滴定管量取20.00mL高锰酸钾溶液
(E)为了测定某溶液的pH,将水经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H)浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
(J)在氢氧化铁胶体中加主少量硫酸会产生沉淀
(K)用结晶法可以除去硝酸钾中混有少量氯化钠
(2)(11分) ![]() 、
、![]() 均为难溶于水的白色固体.某同学向
均为难溶于水的白色固体.某同学向![]() 溶液中滴加
溶液中滴加![]() 溶液至恰好反应,生成白色沉淀.试设计一个简单的实验方案,来证明所生成的白色沉淀是
溶液至恰好反应,生成白色沉淀.试设计一个简单的实验方案,来证明所生成的白色沉淀是![]() 还是
还是![]() .(已知:
.(已知:![]() 水解程度大于电离程度)
水解程度大于电离程度)
| 实验原理______________________________________________________ 实验用品及试剂:烧杯、玻璃棒、试管、滴管;石蕊试液、酚酞、pH试纸 |
| 实验步骤、现象及结论:(可以不填满) 1.___________________________________________________________ 2.___________________________________________________________ 3.___________________________________________________________ 4.___________________________________________________________ 5.___________________________________________________________ |
20、(9分)某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应的速率不同,但是产生的氢气的体积相同。
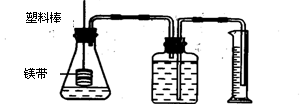 在下图装置中的锥形瓶中分别装入1mol·L-1的盐酸和醋酸各10mL,进行实验。
在下图装置中的锥形瓶中分别装入1mol·L-1的盐酸和醋酸各10mL,进行实验。
(1)分别称取除去表面氧化膜的镁带a g,并系于塑料棒末端。则a的数值至少为_____g
(2)本实验中应选用_______(填序号)的量筒。
A.100mL B.200mL C.500mL
(3)在广口瓶中装足量的水,按图连好装置后,要_____
(4)将塑料棒向下移动,使镁带全部浸入酸中,至酸反应完全。为了比较反应速率,应
记录的实验数据是____________________;为了比较产生氢气的体积,应记录的数
据是 _____________。实验结果表明:镁带和盐酸的反应速率比镁带和醋酸的
反应速率______(填“快”或“慢”),理由是 。
(5)下列情况中可能导致反应速率变快的是_______(填序号,多填扣分,下同);可能
导致产生氢气的体积减小的是
A.镁带中含有少量跟酸不反应的杂质
B.没有除去镁带表面的氧化镁
C.镁带中含有少量杂质铁
四、(本题包括2小题,共20分)
21、(11分)右图是中学化学中常见物质之间的相互转化关系。其中,X是气体单质,Y是液体化合物,Z是常见的碱且焰色反应为黄色;W、L是固体单质,K、I中含有相同的元素;反应①是高温下进行的工业上制取H的第一步反应。
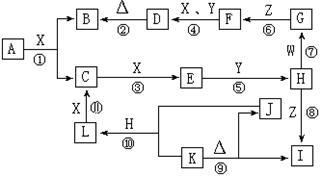
请按要求填空:
(1)G、H的化学式分别为
G 、 H ,
Y、Z的电子式分别为
Y 、Z ;
(2)写出下列反应的化学方程式:
① ;
④ ;
⑨ ;
(3)反应⑩中生成 1molL时,转移的电子数为 。(16分)右图是中学化学中常见物质之间的相互转化关系。其中,X是气体单质,Y是液体化合物,Z是常见的碱且焰色反应为黄色;W、L是固体单质,K、I中含有相同的元素;反应①是高温下进行的工业上制取H的第一步反应。
22、(9分)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如下图所示:
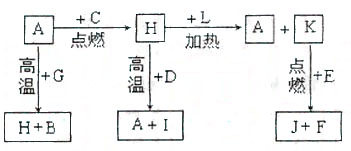
请回答下列问题:
(1)元素A在元素周期表中的位置为
周期
族。 (2)写出K的电子式 。
(3)写出H和D反应的化学方程式 。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式
。
(5)写出A与G反应的化学方程式 。
(6)K与E反应时产生的现象有
;
该反应的化学方程式为 。
五、(本题包括2小题,共17分)
23.(8分)在一个固定体积的密闭容器中,向容器中充入2 mol A和1 mol
B,发生如下反应:2A(g) + B(g) ![]() 3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
⑴若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应。
⑵若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A+2 mol B ②3mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
⑶某温度下,向容器中加入3 mol C和0.8 mo1 D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于_________L,小于________L。
24、(9分)一种用于治疗高血脂的新药灭脂灵(Hepronicate)是按如下路线合成的:
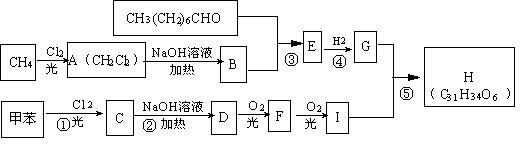
已知:
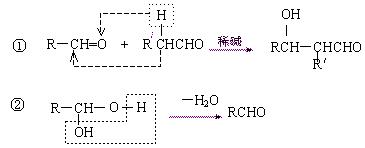
其中G的分子式为C10H22O3
,试回答:
(1)写出结构简式: B
E
;
(2)上述反应中属于取代反应的是
(填序号);
(3)写出反应方程式:
Ⅰ、反应②
;
Ⅱ、反应⑤
;
Ⅲ、F与银氨溶液反应:
。
六、(本题包括2小题,共16分)
25、(6分)在20℃时食盐水的溶解度为36g,取一定量该温度下的饱和溶液用惰性电极进行电解,当阳极析出11.2L气体时(标准状况),食盐水完全电解,所得溶液密度为1.20g/mol。试计算:
(1)电解时,所取饱和食盐水的质量为 g。
(2)电解后溶液中NaOH的物质的量浓度为 mol/L。
(3)要使溶液恢复原状态,需加入 g, 物质
26、(10分)Fe2O3、ZnO、CuO的混合固体粉末a g,在加热条件下用足量的CO还原,得到金属混合物2.41g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00g白色沉淀。
(1)a=
g。
(2)若a
g Fe2O3、ZnO、CuO的混合物总物质的量为bmol,则Fe2O3的物质的量为
mol。(用b的代数式表示)
(3)将a
g Fe2O3、ZnO、CuO的混合物溶于足量的盐酸中,再加入适量的铁粉,溶液中的Fe3+、Cu2+全部被还原,同时收集到224mL H2(标准状况下),共用去0.03mol铁粉。求原混合物中Fe2O3、ZnO、CuO的物质的量分别是多少?
19 BCDGJK
20.(1)原理:若生成物的混合物显强酸性,则生成的沉淀为![]()
![]() .若生成物的混合物不显酸性,则生成的沉淀为
.若生成物的混合物不显酸性,则生成的沉淀为![]()
![]() (2)A:将氯化钙溶液滴入到
(2)A:将氯化钙溶液滴入到![]() 溶液中过量至不再沉淀为止. B:沉淀静置 C:取一小段pH试纸放在干燥洁净的表面皿.用洁净干燥的玻璃棒蘸取溶液滴到pH试纸 D:与标准比色卡对照,若溶液呈酸性,则证明生成的为
溶液中过量至不再沉淀为止. B:沉淀静置 C:取一小段pH试纸放在干燥洁净的表面皿.用洁净干燥的玻璃棒蘸取溶液滴到pH试纸 D:与标准比色卡对照,若溶液呈酸性,则证明生成的为![]() ;反之则证明为
;反之则证明为![]() .
.
20(1)0.12 (2分) (2)B (1分)(3)检查装置的气密性 (1分)(4)反应起止的时间 (1分) 排入量筒中水的体积 (1分) 快 (1分)同浓度的盐酸比醋酸溶液中的H+ 浓度大 (1分) (5)AC (2分) B (1分)
21、
(1)FeSO4 H2SO4 Y(H2O)、Z(NaOH)的电子式略
(2)①4FeS2+11O2![]() 2Fe2O3+8SO2 ④4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe2O3+8SO2 ④4Fe(OH)2+O2+2H2O=4Fe(OH)3
⑨4Na2SO3![]() 3Na2SO4+Na2S (3)
3Na2SO4+Na2S (3)![]() NA
NA
22(1)四;VIII(2):O::C::O:(3)3Fe3O4+8Al
![]() 4Al2O3+9Fe
(4)2Al+2OH-+2H2O=2AlO2-+3H2↑(5)3Fe+4H2O(g)
4Al2O3+9Fe
(4)2Al+2OH-+2H2O=2AlO2-+3H2↑(5)3Fe+4H2O(g) ![]() Fe3O44H2↑
Fe3O44H2↑
(6)镁带剧烈燃烧,放出耀眼的光,瓶壁出现白色固体和黑色颗粒:
2Mg+CO2 ![]() 2MgO+C
2MgO+C
23
⑴吸热 ⑵③ ⑶0.5 2.5 (每空2分,共8分)
24、(1)HCHO, 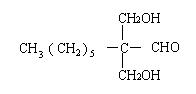
(2)①②⑤
(3)
Ⅰ、 ![]()
Ⅱ、 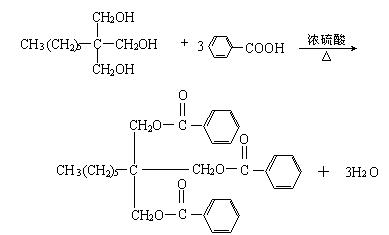
Ⅲ、 ![]()
31.(1)221 (2)6.5 (3)3.65 HCl
25、(1)3.21g (2)0.025 --1/2b(3)Fe2O3、ZnO、CuO的物质的量分别是0.01mol、0.01mol、0.01mol。