泰安二中高三化学模拟试卷2006、9、28(50分钟)
可能用到的相对原子质量:H~1,C~12,N~14,O~16, Na~23,S~32,Cl~35.5,K~39,Ca~40, Fe~56,Cu~64,Zn~65。
第I卷(选择题 共48分)
一、选择题(本大题包括8个小题,共32分。每小题只有一个选项符合题意)
1.下列说法正确的是
.... A.NaCl溶液、MgCl2溶液、KNO3溶液、Al2(SO4)3溶液可以用一种试剂加以区别
B.合成氨工业与接触法制硫酸中SO2催化氧化的过程中都采用了高压的生产条件
C.在医院中为酸中毒病人输液不应采用0.9%氯化铵溶液
D.汽车排放的尾气中含有氮氧化物的主要原因是汽油燃烧不充分引起的
2.接触法生产H2SO4过程,对废气、废水、废渣、“废热”的处理正确的是
①尾气用氨水处理;
②污水用石灰乳处理;
③废渣用来造水泥,炼铁;
④设置“废热”锅炉产生蒸气,供热或发电
A.只有①② B.只有①③④ C.只有①②③ D.全部
3.常温下,下列各组物质不能用一种试剂通过化学反应区别的是
A.MnO2 CuO FeO B.Na2CO3 NaHCO3 K2CO3
C.AgNO3 KNO3 Na2CO3 D.(NH4)2SO4 K2SO4 NH4Cl
4.某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液中肯定不存在的离子是
A.Al3+、Mg2+、I-、SO32- B.Mg2+、Na+、CO32-、I-
C.Al3+、Na+、SO32-、I- D.Al3+、CO32-、Br-、SO32-
5.下列离子方程式正确的是
A.澄清石灰水中滴加稀硝酸:
Ca(OH)2 + 2H+ ![]() Ca2+ + 2H2O
Ca2+ + 2H2O
![]() B.用Pt电极电解饱和氯化镁溶液:
B.用Pt电极电解饱和氯化镁溶液:
2Cl-+2H2O 2OH-+H2↑+Cl2↑
C.向FeBr2溶液中通入过量氯气:
2 Fe2+ + Cl2 ![]() 2Fe3+ + 2Cl-
2Fe3+ + 2Cl-
D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:
Ca2+ + 2HCO3- +2OH- ![]() CaCO3 ↓+ CO32-+ 2H2O
CaCO3 ↓+ CO32-+ 2H2O
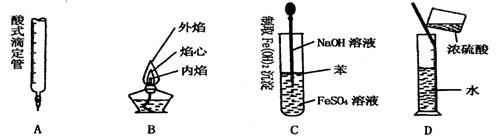
6.下列对实验仪器名称的标注或实验操作,正确的是
7.NA表示阿伏加德罗常数,下列说法正确的是
A.电解CuCl2溶液,阴极析出16g铜时,电极上转移的电子数为NA
B.标准状况下,22.4L氖气中含有NA个氖原子
C.SiO2晶体中每摩尔硅原子可与氧原子形成2NA个共价键
D.2L 1mol/L (NH4)2SO4的溶液中含有4NA个铵根离子
8.为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是
| 不纯物质 | 除杂试剂 | 分离方法 | |
| A | 苯(甲苯) | KMnO4(酸化),NaOH溶液 | 分液 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 乙酸乙酯(乙酸) | KOH溶液,水 | 分液 |
| D | 苯(苯酚) | 浓Br2水 | 过滤 |
二、(本大题包括4个小题,共16分。每小题只有一个选项符合题意)![]()
9.FeS2在空气中充分燃烧的化学方程式为4FeS2 + 11O2 2Fe2O3 + 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
A.120N/a B.120a/11N C.11a/120N D.120N/11a
10.下列分散系中,分散质微粒半径最小的是
A.雾 B.蛋白质溶液
C.NaCl溶液 D.新制Cu(OH)2悬浊液
11.以下集气装置中不正确的是
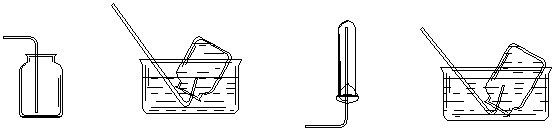
A.H2S的收集 B.NO的收集 C.NH3的收集 D.Cl2的收集
(液体为H2O) (试管口为棉花) (液体为H2O)
12.单质A能在溶液中置换单质B,则单质A不可能是
A. 氯气 B. 铜 C.氢气 D. 碳
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
第II卷(非选择题,共52分)
三、(本大题包括2个小题,共22分)
13.(8分)(1)在进行性质实验方案的设计时,要充分了解物质的_________、_________、_________和____ 之间的相互关系。要根据物质的___________,设计实验方案来探索和验证物质所具有的一些性质。
(2)下列实验中所选用的仪器或操作以及结论不合理的是________
A.用托盘天平称量重11.7g氯化钠晶体
B.用碱式滴定管量取25.00mL溴水
C.不宜用瓷坩埚灼烧氢氧化钠、碳酸钠
D.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
E.仅用蒸馏水和pH试纸作试剂,就可鉴别pH相等的H2SO4和CH3COOH溶液
14.(14分)
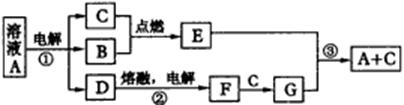
A、B、C、D、E、F、G是由短周期元素组成的七种物质,其中B、C、F是单质;常温下B、C、E为气体;A物质的焰色反应呈黄色。(下图中反应②的部分产物未表示出来。)
|
|
| 各物质间的转化关系 |
根据上图所示转化关系回答:
(1)经测定G属于离子化合物,其电子式为___________。
(2)反应③的化学方程式为 ___________ 。
(3)这七种物质中含有共价键的有___________ (用化学式回答)。
四、实验题(本题30分)
15.(14分)为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题。
[方案I](1)称取碳酸钙样品 M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积 V mL。
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会 (偏高、偏低、无影响)
[方案II](1)称取碳酸钙样品 M g;
(2)用c mol/L 盐酸 V mL(过量)溶解样品;
(3)取溶解后的溶液![]() mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)
。
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定 (填选项编号)。
A.需要 B.不需要 C.均可
问题3:碳酸钙纯度计算公式 。
[方案III](1)称取碳酸钙样品 M g;
(2)高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M′g。
问题1:为什么要煅烧至1000℃且“直至质量不再改变”?
;
问题2:本方案中的“冷却”应如何操作
。
[方案IV](1)称取碳酸钙样品 M g;
(2)加入足量Cmol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量C′mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题1:此方案中不需要的数据是 (填选项编号)。
A.C、V B.C′、 V′ C. M′ D. M
问题2:为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液体积V′ mL
B.精确配制浓度C′mol/LNa2CO3溶液
C.将步骤(3)所得沉淀洗涤,洗涤也应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钠纯度将
(偏高、偏低、无影响)。
综上所述,你认为4个方案中,最好的方案是 ,其它方案的缺点分别是:
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案 ; 。
方案 ; 。
泰安二中高三化学模拟试卷2006、10、8
1.C 2.D 3.B 4.A 5.D 6.C 7.B 8.A 9.D 10 C 11 AD 12 CD
13.(6分)(1)结构 性质 用途 制法(4分);结构特点(1分)
(2)BD(3分,选1个得1分,错选得0分)
14.(8分)(1)Na+[∶H]-(3分)(2)NaH+HCl=NaCl+H2↑(3分)
(3)H2、Cl2、NaOH、HCl (8分)
15.(30分)
方案Ⅰ:偏低(2分)
方案Ⅱ:①托盘天平(砝码)、药匙、酸式和碱式滴定管、锥形瓶(4分)
②B (2分)
③ ![]() (2分)
(2分)
方案Ⅲ:①保证CaCO3完全分解 (2分)②应在干燥中冷却(2分)
方案Ⅳ:①A、B (2分) ②C (2分) ③偏高((2分)
方案Ⅱ(2分)
方案Ⅰ:气体体积难以准确测量(4分)
方案Ⅲ:实验室难以提供1000℃的高温(4分)
泰安二中高三化学模拟试卷2006、10、8
1.C 2.D 3.B 4.A 5.D 6.C 7.B 8.A 9.D 10 C 11 AD 12 CD
13.(6分)(1)结构 性质 用途 制法(4分);结构特点(1分)
(2)BD(3分,选1个得1分,错选得0分)
14.(8分)(1)Na+[∶H]-(3分)(2)NaH+HCl=NaCl+H2↑(3分)
(3)H2、Cl2、NaOH、HCl (8分)
15.(30分)
方案Ⅰ:偏低(2分)
方案Ⅱ:①托盘天平(砝码)、药匙、酸式和碱式滴定管、锥形瓶(4分)
②B (2分)
③ ![]() (2分)
(2分)
方案Ⅲ:①保证CaCO3完全分解 (2分)②应在干燥中冷却(2分)
方案Ⅳ:①A、B (2分) ②C (2分) ③偏高((2分)
方案Ⅱ(2分)
方案Ⅰ:气体体积难以准确测量(4分)
方案Ⅲ:实验室难以提供1000℃的高温(4分)