![]()
 省扬中﹑省港中﹑省句中三校期中联考
省扬中﹑省港中﹑省句中三校期中联考
高一化学(实验班)试题
2005年11月
命题人:蒋朝阳 审题人:刘 骅
原子量:H:1 C:12 O:16 Mn:55 Na:23 S:32 K:39 Br:80 Cl:35.5
一.选择题:(本题共8小题,每题只有一个正确答案,共24分)
1.下列物质的水溶液能导电,但属于非电解质的是 ( )
A.CH3COOH B.Cl2 C.NH4HCO3 D.SO2
2.能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶无色溶液加以区别的一种试剂是(必要时可以加热) ( )
A.BaCl2 B.NaOH C.Ba(OH)2 D.AgNO3
3.浊液区别于其他分散系最本质的特征是 ( )
A.外观浑浊不清 B.浊液没有丁达尔现象
C.不稳定 D.分散质粒子直径大于10-7m
4.下列从海带中提取碘的流程设计中,合理的是 ( )
A.氧化→浸泡→过滤→萃取 B.浸泡→氧化→过滤→萃取
C.浸泡→萃取→过滤→氧化 D.浸泡→过滤→萃取→氧化
5.下列关于Cl2的描述中,正确的是 ( )
A.Cl2以液态形式存在时可称作氯水或液氯
B.红热的铜丝在Cl2中燃烧后生成蓝色的CuCl2
C.Cl2既可作氧化剂,又可作还原剂 D.Fe在Cl2中燃烧生成FeCl2
6.在无土栽培中,需配制一定量含50 mol NH4Cl﹑ 6 mol KCl和24 mol K2SO4的营养液.若用KCl﹑NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是(单位是mol) ( )
A.2﹑54﹑24 B.54﹑2﹑24 C.32﹑50﹑12 D.16﹑50﹑24
7.下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是
( )
A.Na+、Ba2+、Cl-、SO42- B.K+、SO42- 、NO3-、OH-
C.H+、NH4+、Al3+、SO42- D.H+、Cl-、CO32-、NO3-
8.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢(H2O2)为原料制取氧气,当制得同温、同压下相同体积的O2时,三个反应中转移的电子数之比为( )
A.1:1:1 B.2:2:1 C.2:3:1 D.4:3:2
二.选择题(本题共10小题,每题有1~2个正确答案,共30分)
9.20℃时,饱和KCl溶液的密度为1.174 g﹒cm-3,物质的量浓度为4.0 mol﹒L-1 ,则下列说法中不正确的是 ( )
A. 25℃时, 饱和KCl溶液的浓度大于4.0 mol﹒L-1
B.此溶液中KCl的质量分数为![]() %
%
C. 20℃时,密度小于1.174 g﹒cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g﹒cm-3
10.设NA为阿伏加德罗常数.下列叙述中正确的是 ( )
A.46g NO2和N2O4混合气体中含有原子数为3NA
B.标准状况下22.4L H2中含中子数为2NA
C.1L 1mol/L 醋酸溶液中离子总数为2NA
D.1mol Mg 与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
11.等量的钠分别跟过量的重水(![]() )与过量的纯水(
)与过量的纯水(![]() )完全反应。下列叙述中正确的是
( )
)完全反应。下列叙述中正确的是
( )
A.当![]() 和
和![]() 的质量相等时,反应后放出的气体的质量相等
的质量相等时,反应后放出的气体的质量相等
B. ![]() 和
和![]() 的物质的量相等时,反应后放出的气体体积相等(相同状况)
的物质的量相等时,反应后放出的气体体积相等(相同状况)
C.当![]() 和
和![]() 的物质的量相等时,反应后放出的气体质量相等
的物质的量相等时,反应后放出的气体质量相等
D.当![]() 和
和![]() 的质量相等时,反应后生成的溶液中NaOH的物质的量浓度相等
的质量相等时,反应后生成的溶液中NaOH的物质的量浓度相等
12.常温下,在下列溶液中发生如下反应:
①16H+ + 10Z-+ 2XO4- === 2X2+ + 5Z2 + 8H2O
②2A2+ + B2 === 2A3+ + 2B-
③2B- + Z2 === B2 + 2Z-
由此判断下列说法错误的是 ( )
A.反应Z2 + 2A2+ === 2A3+ + 2Z-可以进行 B.Z元素在①③反应中均被还原
C.氧化性有强到弱的顺序是XO4-、Z2、B2、A3+
D.还原性有强到弱的顺序是A2+、B-、Z-、X2+
13.纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体,下列区分这两种物质的方法正确的是 ( )
A.分别用砂锅加热两种样品,全部分解挥发没有残留物的是小苏打
B.用洁净铁丝蘸取两种样品在煤气火焰上灼烧,使火焰颜色发生明显变化的是小苏打
C.用两只小玻璃杯,分别加入少量的两种样品,再加入等量的食醋,产生气泡快的是小苏打
D.先将两样品配成溶液,分别加入澄清石灰水,无白色沉淀生成的是小苏打
14.下列离子方程式中,正确的是 ( )
A.醋酸与小苏打溶液反应 H++HCO3-===CO2+H2O
B.氯气溶于水 H2O+Cl2![]() H++Cl-+HClO
H++Cl-+HClO
C.铁与三氯化铁溶液反应 Fe + Fe3+ === 2Fe2+
D.碳酸氢钠溶液与少量澄清石灰水反应 2HCO3- +Ca2+ + 2OH-===CaCO3↓+2H2O+CO32-
15.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制取2KClO3 + H2C2O4
+ H2SO4 ![]() 2ClO2↑+
K2SO4 + 2CO2↑+ 2H2O
( )
2ClO2↑+
K2SO4 + 2CO2↑+ 2H2O
( )
A.KClO3在反应中得到电子 B.ClO2是氧化产物
C.H2C2O4在反应中被氧化 D.1mol KClO3参加反应有2mol电子转移
16.由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以生成Cl2。下列关于混盐CaOCl2的有关判断不正确的是 ( )
A.该混盐与硫酸反应产生1mol Cl2时转移2NA个电子 B.该混盐的摩尔质量为127
C.该混盐具有较强的氧化性 D.该混盐中氯元素的化合价为+1和-1
17.可以证明次氯酸为弱酸的实验事实是 ( )
A.次氯酸具有强氧化性 B.次氯酸不稳定,见光即分解
C.可与强碱发生中和反应 D.其盐可与弱酸发生复分解反应
18.将0.2 mol MnO2和50 mL 12 mol﹒L-1的盐酸混合后缓缓加热,反应完全后留下的溶液中加入足量的AgNO3溶液,生成AgCl沉淀的物质的量为(不考虑盐酸的挥发) ( )
A.等于0.3 mol B.小于0.3mol C.大于0.3mol, 小于0.6mol D.以上都不正确
三.填空题(本题共4小题,共33分)
19.要得到(Ⅰ)中结论,请从Ⅱ﹑Ⅲ中选择相应的字母填入表内,并写出有关化学反应方程式(或说明理由).
| (Ⅰ)实验结论 | 答案 | 有关反应方程式(或简要说明理由) | |
| (Ⅱ) | (Ⅲ) | ||
| ①蛋壳中含有碳酸盐 | |||
| ③粗盐中混有少量钾盐 | |||
| ④芒硝的成分含Na2SO4 | |||
(Ⅱ)实验方法:A.加盐酸;B.加热;C.进行焰色反应;D.加BaCl2溶液;E.加CaCl2溶液
(Ⅲ)实验现象:a.有气体生成;b.有不溶于水的白色沉淀生成;c.呈黄色;d.呈浅紫色(透过蓝色钴玻璃观察)
20.电解原理在化工中有广泛应用。下图是一个电解装置,内装溶液a;X、Y是两根石墨电极,通过导线与直流电源相连。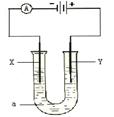
请回答以下问题:
若a是饱和NaCl溶液,实验开始时在两边各滴入几滴酚酞试液,则 极附近溶液变红色,装置内发生反应的化学方程式是 ;
Cl2在 极上生成,检验的方法是 。
21.我国化学家侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
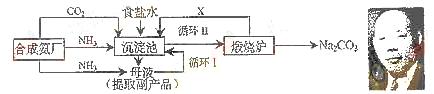
⑴ 上述生产纯碱的方法称_________________,副产品的一种用途为_________________。
⑵沉淀池中发生的化学反应方程式是 __________________________________________。
⑶ 写出上述流程中X物质的分子式_______________________。
⑷ 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了__________(填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是____________________。
⑸ 为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加_____________。
⑹ 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用有_____________。
(a) 增大NH4+的浓度,使NH4Cl更多地析出
(b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
22.一定量的液态化合物XY2,在一定量O2中恰好完全反应, XY2(l)+3O2(g)===XO2(g)+2YO2(g)
冷却后在标准状况下,测得生成物的体积为672 mL,密度2.56 g﹒L-1,则
(1)反应前O2的体积是 mL.
(2)化合物XY2的摩尔质量是 .
(3)在XY2分子中,X﹑Y两元素的质量比为3:16,则X﹑Y两元素分别为
和 .(名称)
四.计算题(本题共2小题,共13分)
23.往100 mL KBr溶液中通入足量的Cl2,将所得溶液蒸干并灼烧固体,冷却后称得固体质量为7.45g,试计算:
(1)原KBr溶液的物质的量浓度.
(2)若用上述方法提取溴,理论上可得溴的质量.
24.取一定量的Na2CO3﹑NaHCO3﹑和Na2SO4的混合物与250 mL 1.00 mol﹒L-1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500 mL 0.100 mol﹒L-1Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0 mL 1.00 mol﹒L-1盐酸恰好中和.计算混合物中各物质的质量.
省扬中﹑省港中﹑省句中三校期中联考
高一化学(实验班)试题
2005年11月
一.选择题:(本题共8小题,每题只有一个正确答案,共24分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
二.选择题(本题共10小题,每题有1~2个正确答案,共30分)
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
三.填空题(本题共4小题,共33分)
19. , , .
, , .
, , .
20. , .
, .
21. (1) , .
(2) .
(3) (4) .
(5) (6)
22. (1) ,
(2) .
(3) , .
四.计算题(本题共2小题,共13分)
23. (1)
(2)
24.
省扬中﹑省港中﹑省句中三校期中联考
高一化学(实验班)试题答案
2005年11月
一.选择题:(本题共8小题,每题只有一个正确答案,共24分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| D | C | D | B | C | B | B | B |
二.选择题(本题共10小题,每题有1~2个正确答案,共30分)
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| D | AD | B | B | C | BD | AC | AB | D | C |
三.填空题(本题共4小题,共33分)
19.(9分) A , a , CaCO3+2H+==== Ca2++H2O+CO2 .
C , d , 钾离子的焰色反应为紫色 .
C D , c b , 钠离子的焰色反应为黄色 Ba2++SO42-==== BaSO4 ↓ .
20.(6分) 阴 , 2NaCl+2H2O===2NaOH+Cl2+H2 .
阳 , 湿润的淀粉碘化钾试纸变蓝 。
21.(本题共10分)
⑴ 联合制碱法或侯德榜制碱法
化肥或电解液或焊药等
⑵ NH3 + CO2 + NaC l+ H2O → NH4Cl + NaHCO3↓
或NH3 + CO2 + H2O → NH4HCO3,NH4HCO3 + NaCl→ NH4Cl + NaHCO3↓
⑶ CO2
⑷ I 过滤
⑸ 稀硝酸和硝酸银溶液
⑹ a、c
22. (8分) (1) 672 mL ,
(2) 76 g/moL .
(3) 碳 , 硫 .
四.计算题(本题共2小题,共13分)
23.(6分) (1) 1 mol/L
(2) 8g
24. (7分) Na2SO4 1.42g
Na2CO3 7.42g
NaHCO3 1.68g