保密★启用前 试卷类型:A
高密市2005——2006学年度上学期期中考试
高三化学试题 2005.10
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 S:32 Cl:35.5 K:39 Fe:56 Cu:64 Zn:65 I:127
第Ⅰ卷(选择题 共60分)
一.选择题(本题包括20小题,每小题3分,共60分。每小题只有一个选项符合题意。)
1.下列表达方式中错误的是
A.氯化氢分子的电子式:![]()
B.S2—结构示意图:![]()
C.O-18原子符号:188O
D.CO2分子结构式:O=C=O
2.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是
A.将SO2通入水中 B.烧碱溶于水
C.将HCl通入水中 D.硫酸氢钠溶于水
3.焰火绽放出的五颜六色是一些金属离子魅力的展示。焰火的主要原料是黑火药,还有草酸钠、碳酸铜(发出绿色的光)等发色剂和氯酸钾、镁铝金属粉末等添加剂。下列说法正确的是
A.碳酸铜因为受热分解才发出绿色的光 B.氯酸钾的主要用途是产生紫色的焰火
C.镁铝在焰火中发出耀眼的白光 D.黑火药的主要成分是木炭、硫磺
4.某溶液中含有HCO3- 、SO32- 、CO32- 、NH4+ 离子,向其中加入Na2O2 固体,溶液中离子浓度增加的是
A.HCO3- B.NH4+ C.CO32- D.SO32-
5.2004年,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质,已知硫化羰与二氧化碳的结构相似,但能在氧气中完全燃烧,下列有关硫化羰的说法正确的是
A.1 mol硫化羰在氧气中完全燃烧时转移6mol电子
B.硫化羰可用作灭火剂
C.CO2和COS结构相似都是非极性分子
D.硫化羰熔点可能较高
6.A、B两元素的原子分别得到2个电子形成稳定结构时,A放出的能量大于B放出的能量;C、D两元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收的能量。A、B、C、D间形成最稳定化合物的化学式为
A.D2A B.C2B C.D2B D.C2A
7.实验室用4mol SO2与2mol O2进行下列反应:
2SO2(g)+O2(g) ![]() 2SO3(g);ΔH=―196.64KJ/mol,当放出314.624KJ热量时,SO2的转化率为
2SO3(g);ΔH=―196.64KJ/mol,当放出314.624KJ热量时,SO2的转化率为
A.40% B.50% C.80% D.90%
8.炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸。下列说法不正确的是
A.CN-可以和稀硫酸反应生成HCN B.CN-可被Cl2氧化成(CN)2
|
9.下列反应的离子方程式正确的是
①硫酸铜溶液与氢氧化钡溶液反应: Ba2++ SO42_= BaSO4↓
②将金属钠加入水中 2Na + 2H2O = 2Na+ + 2OH - + H2 ↑
③石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+ Ca2++CO2↑+H2O
④铁粉和稀盐酸反应:2Fe+6H+==2Fe3++3H2↑
⑤小苏打溶液中加入少量的石灰水:Ca2+ +2OH-+2HCO3-=CaCO3↓+CO32- +2H2O
⑥次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO- + CO2 + H2O =CaCO3↓+ 2HClO
⑦钠与硫酸铜溶液反应:Cu2++2Na =2Na+ +Cu
⑧氯气与水反应Cl2 + H2O = 2H+ + Cl - + ClO-
⑨纯碱溶液中滴加少量盐酸CO32- + H+ = HCO3-
A.①②⑤⑨ B.②③⑤⑨ C.④⑤⑥⑦ D.②③⑧⑨
10.已知X元素的某种同位素与钠元素形成离子化合物的化学式为NaX。该晶体中一个阴离子核外电子数是a,核内中子数是b,则该同位素原子的正确表示为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
11. 在化学学科中经常使用下列物理量,其中跟阿佛加德罗常数无关的组合是
① 相对原子质量 ② 摩尔质量 ③ 原子半径 ④ 键能 ⑤ 物质的量
⑥ 化学反应速率 ⑦ 气体摩尔体积 ⑧ 溶解度 ⑨ 燃烧热 ⑩ 溶质的质量分数
A.①③⑧⑩ B.②④⑤⑥⑦⑨
C.②③④⑤ D.⑥⑦⑧⑨⑩
12.已知2KClO3+I2=2KIO3+Cl2,下列对此反应的说法正确的是
A.氧化产物与还原产物的物质的量比为1:2
B.若在标准状况下产生11.2LCl2,转移电子的物质的量为1mol
C.I2的还原性强于Cl2
D.Cl2和I2都是氧化剂
13.已知H+(aq)+OH-(aq)=H2O(l);DH=-57.3kJ/mol。现有下列反应:
(1)H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l);
(2)H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l);
(3)HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l);
(4)CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);
其中反应热符合DH=-57.3kJ/mol的是
A.(1)(2) B.(2)(3) C.(3)(4) D.都不符合
14.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5 NA
B.如果5.6L N2含有n个氮分子,则阿伏加德罗常数一定约为4n
C.1 mol Na2O2与足量的水反应,转移的电子数为2NA
D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2 NA
15.设NA为阿伏加德罗常数,如果a g某气态双原子分子的分子数为p,则b g该气体在标准状况下的体积V(L)是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
16. 砒霜中毒事件时有发生,砒霜的主要成分是三氧化二砷(As2O3),医生通常给砒霜中毒患者服用一定剂量的氧化剂解毒。下列有关叙述正确的是
A.砷原子最外层有3个电子
B.砷化氢(AsH3)比NH3稳定
C.砷酸(H3AsO4)的酸性强于磷酸
D.砷的+3价化合物的毒性强于+5价化合物
17.下列事实与氢键有关的是
A.水加热到很高温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
18.同温同压下,两个容积相等的储气瓶,一个装满HCl气体,另一个装满H2和Cl2的混合气体,则两瓶内的气体一定具有相同的
A.质量 B.密度 C. 原子总数 D. 质子总数
19.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
20.为了除去NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:3NO2 + 2NaOH→2NaNO3 + NO + H2O;NO2 + NO + 2NaOH→2NaNO2)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为
A.![]() mol/L B.
mol/L B.![]() mol/L
mol/L
C.![]() mol/L D.
mol/L D.![]() mol/L
mol/L
保密★启用前 试卷类型:A
高密市2005——2006学年度上学期期中考试
高三化学试题 2005.10
第Ⅱ卷(共50分)
| 题号 | 二 | 三 | 四 | 总分 |
| 得分 |
| 阅卷人 | 得分 |
二. (本题包括2个小题, 共14分)
21.(4分)下列有关叙述正确的是__________________(填序号,错选倒扣分)
①用小刀切割一小块金属钠后,所剩钠块必须放回原试剂瓶中
②配制500 mL某物质的量浓度的溶液,可用两只250 mL的容量瓶
③用托盘天平称取10.5gNaCl,若药品和砝码位置放颠倒,则称取的NaCl质量偏大
④做焰色反应实验时,若火焰呈黄色,则肯定不含有钾元素
⑤能使湿润的碘化钾淀粉试纸变蓝色的气体一定是氯气
⑥氯水应存放在棕色试剂瓶中
⑦碱金属单质都应存放在煤油中
22.(10分)二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.638。遇水易分解。二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应合成二氯化硫的实验装置。
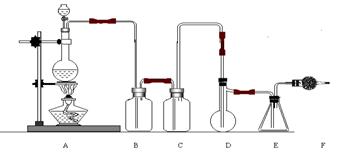
试回答下列问题:
(1)装置A中发生反应的化学方程式为:
(2)装置C盛放的药品是
(3)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁表面形成一薄层,这样做的目的是
(4)实验时,D装置需加热至50-59oC,最好采用何种方式 加热 。
(5)F装置中干燥管内所盛物质的作用是:
。
| 阅卷人 | 得分 |
三. (本题包括3个小题, 共23分)
23.(6分)CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2 L(标准状况),则(1)混合气体中CO的质量是 g; (2)混合气体中CO2在标准状况下的体积是 L;
(3)混合气体在标准状况下的密度是 g·L-1。
24.(9分)已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Z二种元素的元素符号:X 、Z
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为:
(3)由X、Y、Z所形成的常见离子化合物是 .它与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是:
(4)在由X、Y、Z、W四种元素形成的常见单质或化合物中,不能形成的晶体类型是 。
25.(8分)已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | I | e |
| 原子核数 | 单核 | 四核 | 双核 |
| 粒子的电荷数 | 一个单位正电荷 | 0 | 一个单位负电荷 |
物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
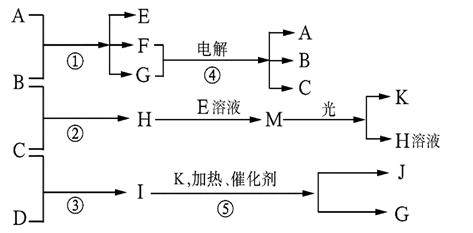
请填写下列空白:
(1)写出下列物质的化学式:B 、J 。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M 。
②反应① 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为:
| 阅卷人 | 得分 |
四. (本题包括2个小题, 共13分)
26.(6分)6.4 g Cu与过量硝酸(a mol / L,30mL)充分反应。硝酸的还原产物只有NO2、NO。反应后溶液中含H+为0.1mol。
(1)此时溶液中所含NO3-为 mol。
(2)求生成的气体中NO2和NO的物质的量各为多少(用含有a的式子表示)?
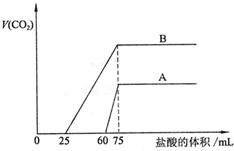
27.(7分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
|
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
,各种溶质的物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
;加盐酸后产生CO2体积最大值 mL。
(3)通过计算求出原NaOH溶液的物质的量浓度。
高密市2005——2006学年度第一学期期中考试
高三化学试题
参考答案
一.选择题(本题包括20小题,每小题3分,共60分。每小题只有一个选项符合题意。)
1~5:ADCCA,6~10:DCCBD,11~15:ACDAD,16~20:DBCBC。
二. (本题包括2个小题, 共14分)
21. (4分)①⑥. (每个2分,错选1个倒扣2分,不得负分。)
22.(10分)
(1)MnO2 +4HCl(浓) ![]() MnO2 +Cl2↑+2H2O
MnO2 +Cl2↑+2H2O
(2)浓硫酸 (3)增大反应接触面
(4)水浴加热
(5)防止空气中水蒸气进入并吸收残留余的氯气。
(以上每空2分,共10分)
三. (本题包括3个小题, 共23分)
23.(6分) (1)7 (2)5.6 (3)1.6(以上每空2分)
24.(9分)
(1) H O
(2) ![]() 或氮化钠、氢化钠的电子式也对
或氮化钠、氢化钠的电子式也对
(3) NH4NO3 NH![]() +OH-
+OH-
![]() NH3↑+H2O
NH3↑+H2O
(4)原子晶体 (以上离子方程式2分,其余每空1分,共9分)
25.( 8分)
(1)B.Cl2 J.NO(每空1分)
(2) ①H+ +ClO-= HClO
②Cl2 + 2OH- == Cl- + ClO- + H2O(每个方程式2分)
(3) 2HCl(g)=H2(g)+Cl2(g);△H= +184.6 kJ·mol-1(2分)
四. (本题包括2个小题, 共13分)
26.(共6分)
(1)0.3(2分)
(2)(4分) 设生成气体中NO2、NO的物质的量分别为X、Y,则由题意得以下方程组:
X+Y=0.03a-0.3
X+3Y=0.2
解之得:X=(0.045a-0.55)mol;
Y=(0.25-0.015a)mol。
(其他合理解法也给分)
27.(7分)
(1)(3分) NaOH、Na2CO3 3∶1 33.6
(2)(2分)Na2CO3、NaHCO3 112
(3)(2分)解:图示表明,向溶液中滴加0.1mol/L的盐酸至不再放出CO2气体时,消耗盐酸的体积为75mL。所以原NaOH溶液的物质的量浓度为:
![]() (其它合理解法可得分)
(其它合理解法可得分)