|
2005-2006学年度上学期
高中学生学科素质训练
高三化学同步测试(1)—《化学反应及能量变化》
可能用到的原子量:Cu:64 N:14 H:1 O:16
第Ⅰ卷 (共72分)
一、选择题(共8小题,每小题4分,每小题只有一个答案符合题意)
1.最近有人用一种称为“超酸”的化合物H(CB11H6Cl6) 和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。这个反应看起来很陌生,但反应类型上却可以跟下列一个化学反应相似,你认为该反应是 ( )
A.NH3 + HCl = NH4Cl B.NaOH + HCl = NaCl + H2O
C.Mg +2HCl = MgCl2 + H2↑
D.H2O +CH3COOH ![]() H3O+ +CH3COO-
H3O+ +CH3COO-
2.(05江苏)氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分
别为:
H2 (g) + 1/2O2(g) == H2O (l); △H = -285.8 KJ/mol
CO(g) + 1/2O2(g) == CO2(g); △H = -283 KJ/mol
C8H18 (l) + 25/2O2(g) == 8CO2(g) + 9H2O (l); △H = -5518 KJ/mol
CH4 (g) + 2O2(g) == CO2(g) + 2H2O (l); △H = -890.3 KJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是 ( )
A.H2 (g) B.CO(g) C.C8H18 (l) D.CH4 (g)
3.对于电解质的导电能力,下列说法正确的是 ( )
A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B.导电能力强的溶液一定是浓溶液
C.相同温度下,导电能力强的溶液中离子个数一定多
D.相同的温度下,单位体积中的离子个数越多,阴离子或阳离子所带电荷的绝对值越
大,溶液的导电能力越强
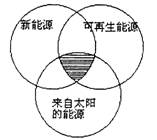
|
全部符合图中阴影部分的能源是( )
A.煤炭、石油、潮汐能
B.水能、生物能、天然气
C.太阳能、风能、沼气
D.地热能、海洋能、核能
5.在反应5NH4NO3![]() 2HNO3+4N2+9H2O中,发生氧化反应与发生还原反应的氮原子个
2HNO3+4N2+9H2O中,发生氧化反应与发生还原反应的氮原子个
数之比是 ( )
A.1:3 B.5:3 C.5:8 D.5:4
6.下列叙述正确的是 ( )
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.金属阳离子被还原后,一定得到该元素的单质
C.核外电子总数相同的原子,一定是同种元素的原子
D.能与酸反应的氧化物,一定是碱性氧化物
7.(05江苏)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是 ( )
A.3Cl2 + 6FeI2 == 2FeCl3 + 4FeI3 B.Cl2 + FeI2 == FeCl2 + I2
C.CO2O3 + 6HCl == 2CoCl3 + 3H2O D.2Fe3+ + 2I— == 2Fe2+ + I2
8.在某溶液中酚酞呈粉红色。下列离子在该溶液中不能大量存在的是 ( )
A.K+ B.Na+ C.Ba2+ D.Al3+
二.选择题(共10小题,每小题4分,每小题有1—2个答案符合题意)
9.下列反应的离子方程式书写正确的是 ( )
A.硫酸铝溶液中加入过量氨水 Al3++3OH- = Al(OH)3¯
B.电解饱和食盐水 2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.碳酸钙与盐酸反应 CaCO3+2H+=Ca2++CO2+H2O
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2=Fe3++2H2O
10.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2: 2KClO3+H2C2O4+H2SO4![]() 2ClO2+K2SO4+2CO2+2H2O下列说法正确的是( )
2ClO2+K2SO4+2CO2+2H2O下列说法正确的是( )
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中被氧化
D.1 mol KClO3参加反应有2 mol 电子转移
11.下列离子方程式正确的是 ( )
A.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+ =Ca2+ +2H2O
B.钠与水的反应Na+2H2O=Na+ +2OH - +H2↑
C.铜片插入硝酸银溶液中Cu+Ag+ =Cu2++Ag
D.大理石溶于醋酸的反应CaCO3+2CH3COOH=Ca2+ +2CH3COO-+CO2↑+H2O
12.下列离子方程式中,正确的是 ( )
A.在氯化亚铁溶液中通入氯气 Fe2+ +Cl2 = Fe3+ +2Cl-
B.三氯化铁溶液跟过量氨水反应 Fe3+ +3NH3•H2O = Fe(OH)3↓+3![]()
C.碳酸氢钙溶液跟稀硝酸反应 Ca(HCO3)2 +2H+ = Ca2++2H2O+2CO2↑
D.氯气通入冷的氢氧化钠溶液中 2Cl2+2OHˉ = 3Cl- +ClOˉ +H2O
13.已知某溶液中存在较多的H+、![]() 、
、![]() ,则该溶液中还可能大量存在的离子组是
,则该溶液中还可能大量存在的离子组是
( )
A.Al3+、CH3COO-、Cl- B.Mg2+、Ba2+、Br-
C.Mg2+、Cl-、I-
D.Na+、![]() 、Cl-
、Cl-
14.在怛容条件下,化学反应: 2SO2 ( g ) +
O2 ( g )![]() 2SO3( g ) ;△ H =-QkJ·mol-1在上述条件下分别充人的气体和反应放出的热量 ( Q>0 )如下表所列:
2SO3( g ) ;△ H =-QkJ·mol-1在上述条件下分别充人的气体和反应放出的热量 ( Q>0 )如下表所列:
| 容 器 | SO2 (mol) | O2(mol) | N2(mol) | Q(kJ·mol-1) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是 ( )
A.在上述条件下反应生成 lmolSO3 固体放热 Q/2 kJ
B.2Q1 <2Q2=Q1<Q
C.Ql =2 Q2= 2Q3 = Q
D.2Q2 = 2Q3 < Q1 < Q
15.已知:
(1) H2(g)+![]() O2(g)=H2O(g);DH1=a kJ·mol-1
O2(g)=H2O(g);DH1=a kJ·mol-1
(2) 2H2(g)+O2(g)=2H2O(g);DH2=b kJ·mol-1
(3) H2(g)+![]() O2(g)=H2O(l);DH3=c kJ·mol-1
O2(g)=H2O(l);DH3=c kJ·mol-1
(4) 2H2(g)+O2(g)=2H2O(l);DH4=d kJ·mol-1
下列关系式中正确的是 ( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
16.已知葡萄糖的燃烧热是2804 kJ / mol,当它氧化生成1 g水时放出的热量是 ( )
A.26.0 kJ B.51.9 kJ C.155.8 kJ D.467.3 kJ
17.从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4. 下列说法正确的是 ( )
A.Cu2S既是氧化产物又是还原产物
B.5 mol FeS2发生反应,有10 mol电子转移
C.产物中的SO42-离子有一部分是氧化产物
D.FeS2只作还原剂
18.不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的
已知 H2O(g)=H2O(l);△H1=Q1 kJ/mol
C2H5OH(g)=C2H5OH(l);△H2=Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H3=Q3 kJ/mol
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为 ( )
A.Q1+Q2+Q3 B.0.5(Q1+Q2+Q3)
C.0.5Q1-1.5Q2+0.5Q3 D.1.5Q1-0.5Q2+0.5Q3
第Ⅱ卷 (共78分)
三、实验题(本题有2小题,共18分)
19.(6分)某溶液可能存在NH4+、SO42-、K+离子,请根据下列实验事实回答:
(1)与NaOH溶液共热,放出能使湿润的红色石蕊试纸变蓝色的气体,则溶液中一定含有
_____离子。
(2)用铂丝蘸少许溶液在无色火焰上灼烧,透过蓝色钴玻璃观察到紫色火焰,则溶液中一
定含有 ___ 离子。
(3)若往溶液中加入BaCl2溶液和稀HNO3,没有沉淀生成,则溶液中一定不含 离子。
20.(12分)某化学兴趣小组在学习了卤素以后,做了下列实验:
实验Ⅰ:向2 mL 0.1 mol/L滴有淀粉溶液的KI溶液中加入2滴饱和氯水。
实验Ⅱ:向2 mL 0.1 mol/L滴有淀粉溶液的KI溶液中加入2mL相同的饱和氯水。
实验结果:实验Ⅰ的现象非常明显,溶液很快变为蓝色,而实验Ⅱ中溶液却没有出现蓝
色。对此,四位同学分别发表了自己的观点和猜想。
甲同学认为:实验Ⅰ中生成了碘,而实验Ⅱ中则没有碘生成,所以实验现象不同;
乙同学认为:实验中所用的氯水放置的时间太长,已经变质,所以实验现象不同;
丙同学认为:实验Ⅱ中所用氯水太多,过量的氯水将淀粉反应了,所以溶液没有出现蓝色;
丁同学认为:化学反应的条件和药品的用量都会影响反应的发生,所以导致实验现象不
同。
请你参与他们的讨论,解决下列问题:
(1)根据已有的知识,你认为四位同学的观点中,明显不合理的是______。对上述实验
中的不同现象,你的猜想是________________________________。
(2)写出实验Ⅰ中发生置换反应的离子方程式_____________________________。
(3)实验是解决问题的重要手段。如果要判断乙同学的观点是否正确,可以通过________
实验来进行确认。如果要判断丙同学的猜想是否合理,你认为继续进行的实验操作是___
______________________________ _。
(4)丁同学的观点存在于我们学过的化学知识中,请你用二个化学方程式表示不同的反
应条件对相同物质之间反应的不同影响:_________________________________。
四、填空题(共45分)
21、(13分)
把煤作为燃料可以通过下列两种途径:
途径I:![]()
途径II:先制水煤气:
![]()
再燃烧水煤气:![]()
![]()
试回答下列问题:
(1)判断两种途径放热:途径I放出的热量___________(填“大于”、“等于”、“小于”)
途径II放出的热量。
(2)Q1、Q2、Q3、Q4的数学关系式是_____________________________。
(3)由于制取水煤气反应里,反应物所具有的总能量______________生成物所具有的总
能量,那么在化学反应时,反应物应需要______________能量才能转化为生成物,
因此其反应条件为______________。
(4)简述煤通过途径II作为燃料的意义。
_______________________________________________________________________
_____________________________________________________________________。
22.(6分)一种澄清透明的溶液中可能含有下列离子:K+、Fe3+、Ba2+、Al3+、NH4+、Cl-、
NO3-、HCO3-、SO42-现做以下实验:
(1)将溶液滴在蓝色石蕊试纸上,试纸呈红色
(2)取少量溶液,加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀
(3)将(2)中的沉淀过滤。由滤液中加入硝酸银溶液,产生白色沉淀
(4)另取溶液,逐滴加入氢氧化钠溶液至过量,只观察到有棕色沉淀生成,且沉淀量不
减少。由此可以推断:
溶液中肯定存在的离子有: 。
溶液中肯定不存在的离子有: 。
溶液中还不可能确定是否存在的离子有: 。
23.(12分)(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,写出发生反应的离子
方程式:________________________________________.在以上中性溶液中,继续滴加
Ba(OH)2溶液,写出此步反应的离子方程式:___________________________.
(2)向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀为止,写出反应的
离子方程式: ________________________________________.
在以上溶液中,继续滴加NaHSO4溶液,写出此步反应的离子方程式:
________________________________________.
(3)向Ba(OH)2溶液中,逐滴加入明矾溶液至溶液中Ba2+恰好完全沉淀,其反应的离子
方程式为 ________________________________________.
在上述溶液中,继续滴加明矾溶液,请写出此步反应的离子方程式:_________________.
24.(14分)X、Y、Z、是主族元素的单质;U、V是化合物.它们有如下反应(式中
系数和条件已省去)
① X+U → V+Y
② X+Z → V
③ Y+Z → U
(1)若X和Y的组成元素不是同一族.请写出符合①式的3个不同的化学方
程式,并配平.3个式子中的3种X和3种Y,分别由不同族的元素组成.
①_____________________________________________
②_____________________________________________
③_____________________________________________
(2)今有化合物W,它跟化合物U或CO2反应,都能生成单质Y.符合该条件并符合
题设的3个一般方程的单质及化合物分别是(填化学式)
单质______________ 单质__________________
单质______________ 化合物_________________
四、计算题(15分)
25.(6分)浓硫酸与铜在加热时反应,生成二氧化硫气体的体积为2.24 L(标准状况)。试计
算:
(1)反应后生成硫酸铜的物质的量。
(2)若将生成的硫酸铜配制成500 mL溶液,则该溶液中溶质的物质的量浓度是多少?
26.(9分)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混
合气体在标准状况下的体积为11.2 L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液加入V mL a mol / L的NaOH溶液,恰好使溶液
中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为 mol / L。
参考答案
一、二、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | A | B | D | C | B | C | A | D | BC |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | AC | D | B | D | D | C | A | C | D |
三、实验题
19、(1) NH4+ (2) K+ (3)SO42-
20、
(1)乙;生成的碘被继续氧化(或其它合理的答案)
(2)Cl2+2I-=2Cl-+I2
![]() (3)漂白;将淀粉加入氯水中,观察溶液的黄绿色是否褪色
(3)漂白;将淀粉加入氯水中,观察溶液的黄绿色是否褪色
(4)4Na+O2=2Na2O
四、填空题
21、(1)等于
(2)Q1=Q2+Q3+Q4
(3)低于;吸收;高温
(4)固体煤经处理变为气体燃料后,不仅在燃烧时可以大大减少![]() 和烟尘对大气造成
和烟尘对大气造成
的污染,而且燃烧效率高,也便于输送。
22、(1) SO42-、Fe3+ (2) Ba2+、Al3+、NH4+、HCO3- (3) Cl-、NO3- K+
![]() 23、(1)
23、(1)![]() ;
;
(2)![]() ;
;![]()
(3)![]() ;
;![]()
![]()
24、(1)① C+H2O![]() CO+H2② Cl2+H2S=S+2HCl ③ 2Mg+CO2=2MgO+C
CO+H2② Cl2+H2S=S+2HCl ③ 2Mg+CO2=2MgO+C
(2)Y-F2、Y-O2、Y-H2、W-Na2O2
五、计算题
25、(1) Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑ + 2H2O
CuSO4 + SO2↑ + 2H2O
1 mol 22.4 L
n(CuSO4) 2.24 L
1 mol∶n(CuSO4)=22.4 L∶2.24 L
n(CuSO4)=0.1 mol (2分)
(2) c(CuSO4)=![]() =0.2 mol / L (1分)
=0.2 mol / L (1分)
26、(1)5.8;5.4 (2)
![]()