|
2005-2006学年度上学期
高中学生学科素质训练
高三化学同步测试(2)—《碱金属》
第I卷(选择题,共72分)
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Mg 24 S 32 Ba 137 Ca 40
Cu 64 K 39 Cl 35.5 Al 27 P 31
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是 ( )
A.NaHSO4 B.NaHCO3 C.Na2SO3 D.NH4NO3
2.工业上制取金属钠的方法是 ( )
A.用钾作还原剂 B.电解饱和食盐水
C.电解熔融氯化钠 D.电解氢氧化钠溶液
3.欲除去小苏打溶液中混有的少量苏打,最好向溶液中加入(或通入) ( )
A.熟石灰 B.CO2 C.Ca(HCO3)2 D.盐酸
4.下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物种
类改变的是 ( )
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.C 和O2
5.①氧化钠、②氢氧化钠、③过氧化钠、④亚硫酸钠。1mol上述固体物质长期放置于空气
中,下列说法中正确的是 ( )
A.上述物质都发生了氧化还原反应 B.过氧化钠在反应中转移了2mol电子
C.质量增加的情况是①>③>④>② D.质量增加的情况是②>①>③>④
6.碱金属溶于汞可形成良好的还原剂“汞齐”。取某种碱金属的汞齐4.6g投入足量的水中产
生2.24L气体(标准状况),并得到密度为d g/cm3的溶液1L,则该溶液中溶质的质量分数
是 ( )
A.(11.2/d)% B. (0.8/d)% C.( 0.48/d)% D.(0.24/d)%
7.将23克金属钠放入足量mg水中,再将24克金属镁放入足量m克稀盐酸中。反应后所
得溶液的质量分别为![]() 克和
克和![]() 克。那么,
克。那么,![]() 和
和![]() 两数值的关系应是 ( )
两数值的关系应是 ( )
A.![]() B.
B.![]() C.
C.![]() D.无法确定
D.无法确定
8.下列盛放物质的方法错误的是 ( )
A.将金属锂保存在煤油中
B.少量的白磷可保存在水中
C.纯碱溶液用带磨口玻璃瓶塞的试剂瓶保存
D.硝酸银溶液盛放在棕色试剂瓶中
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个或两个选项符合题
意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选
一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.关于NaHCO3性质的说法正确的是 ( )
A.只能与酸反应,不能与碱反应
B.医疗可用于冶疗胃酸过多
C.与足量的酸反应时放出的CO2比等质量的Na2CO3要少
D.同温度时,碳酸氢钠的溶解度大于碳酸钠的溶解度
10.将一定量的钠、铝合金置于水中,合金全部溶解,得到20ml、pH=14的溶液.然后用1mol/L
的盐酸滴定至沉淀量最大时,消耗盐酸40ml。原合金中钠的质量为 ( )
A.0.92g B.0.69g C.0.64g D.0.23g
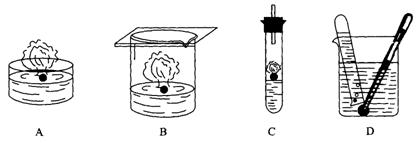
11.在下列四种演示金属钾与水反应的实验装置中正确的是 ( )
12.一定温度下,Wg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,
过氧化钠固体增重Wg,符合此要求的是 ( )
(1)H2 (2)CO (3)CO和H2 (4)HCOOCH3 (5)HOOC-COOH
A.全部 B.仅(4)(5)
C.仅(1)(2)(3) D.除(5)以外
13.15.6g Na2O2溶于bg水中,恰好使Na+离子数与水分子数之比为1:50,则b值为( )
A.360 B.363.6 C.180 D.183.6
14.下列溶液经反应后,溶液内含有0.50 mol NaHCO3和0.50 mol Na2CO3的是 ( )
A.0.50L 1.00 mol·L-1NaHCO3加0.50L 0.50 mol·L-1NaOH
B.0.50L 0.75 mol·L-1 Na2CO3加0.50L 0.50 mol·L-1 HCl
C.0.50L 1.00 mol·L-1 NaHCO3 加0.50L 0.25 mol·L-1 NaOH
D.1.00L 1.00 mol·L-1 Na2CO3 加1.00L 0.50 mol·L-1 HCl
15.有一在空气中暴露过的KOH固体,经分析知其内含水7.62%、K2CO3 2.38%,KOH 90%,若将样品1g加入到1mol·L-1盐酸46mL里,过量的酸再用1.07mol·L-1 KOH溶液中和,蒸发中和后的溶液可得固体质量为 ( )
A.3.43g B.4.00g C.4.50g D.无法计算
16.向含0.14mol Na2CO3的溶液中逐滴加入含一定量HCl的稀盐酸,经充分反应后,溶液中各溶质的物质的量判断可能正确的是 ( )
A. 得0.20mol NaCl和0.08mol NaHCO3
B. 剩0.04mol Na2CO3,得0.20mol NaCl
C. 剩0.06mol HCl,得0.14mol NaCl和0.14mol NaHCO3
D. 得0.06mol NaCl和0.08mol NaHCO3
17.两种有机物以一定比例混合,一定条件下在aL O2(足量)中燃烧,充分反应后恢复到原状态,再通过足量Na2O2层,得到气体仍是aL,下列混合有机物中符合此条件的是
( )
A. CH4 C2H4 B. CH3OH CH3COOH
C. C2H6 HCHO D. HCOOH CH3COOCH3
18.四个可加热的密闭容器中,分别装有;①Na2O2和NaHCO3;②Na2O2和NNH4HCO3;③Na2O2和Ca(HCO3)2;④Na2CO3和NaHCO3。各容器中每种物质均为0.5mol,现将各容器加热至300℃,完全分解后排出气体,四个容器中残留固体只有Na2CO3的容器是
A. ①② B. ②④ C. ②③ D. ①④
第Ⅱ卷 (共78分)
三、填空题
19.(8分)碱金属能形成离子型氢化物。如氢化钠的化学式为NaH,氢化钠具有较强的还原
性。
(1)氢化钠的电子式为____________,氢化钠中氢元素是______价。
(2)NaH能与水剧烈反应生成对应的碱和氢气,写出反应的化学方程式并标明电子转移
的方向和数目_______ ____。该反
应中氧化产物与还原产物的质量比为______________。
20.(3分)加热碳铵并使产物全部变成气态。
(1)若将生成的混合气体依次通过足量的Na2O2和浓H2SO4,Na2O2增重m1g,浓H2SO4
增重n1g.
(2)若将生成的混合气体依次通过足量的浓H2SO4和Na2O2, 浓H2SO4增重n2g, Na2O2
增重m2g.(设有关气体全部被吸收)
则m1、 n1、 m2、 n2的质量由大到小的顺序为 。
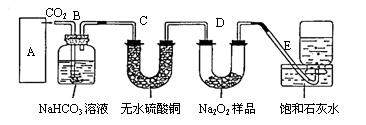 21.(20分)过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为: 2Na2O2
+ 2CO2=2Na2CO3
+ O2 。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如下实验装置:
21.(20分)过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为: 2Na2O2
+ 2CO2=2Na2CO3
+ O2 。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如下实验装置:
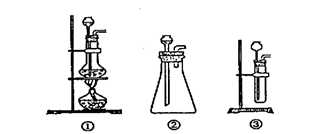 |
(1)A中制取CO2 的装置,应从下列图①、②、③中选哪个图:
B装置的作用是吸收A装置中产生的盐酸酸雾,C装置内可能出现什么现象?
。为了检验E中收集到的气体,在取出
集气瓶后,用 的木条伸入集气瓶内,木条会出现 。
(2)若E中石灰水出现轻微白色浑浊,请说明原因: 。
(3)当D中的1.95克过氧化钠样品接近反应完毕时,你预测E装置内有何现象?
。
(4)反应完毕时,若测得E中的集气瓶收集到的气体为250毫升,又知氧气的密度为1.43
克/升,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值 (大
或小),相差约 毫升(取整数值,所用数据均在标准状况下测定),这是由
于 。
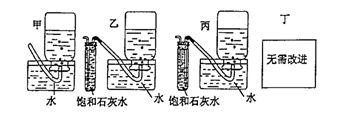
(5)你认为上述A---E的实验装置中,E部分是否安全、合理? ;E是否需要
改进,若需要改进,应改为下图中的 。
22.(12分)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
取25mL甲溶液,向其中缓慢滴入乙溶液15mL,共收集到224mL(标准状况)气体。
取15mL乙溶液,向其中缓慢滴入甲溶液25mL,共收集到112mL(标准状况)气体。
(1)判断:甲是 溶液,乙是 溶液;
(2)实验中所发生反应的离子方程式为: ;
(3)甲溶液的物质的量浓度为 ,乙溶液的物质的量浓度为 ;
(4)将n mL甲溶液与等体积乙溶液按上述两种实验方式进行反应,所产生气体体积为
VmL(标准状况下),则V的取值范围是 。
23.(10分)某澄清溶液中,可能含有NH4+、Mg2-、Na+、Fe2+、Ag+、OH-、Cl-、I-、
NO3-和SO42-等离子中的几种,现进行如下实验:
(1)用pH试纸检验时,试纸呈深红色。
(2)取溶液少许,加入足量CCl4,在不断振荡的条件下加入足量氯水,静置,得上、下
两层澄清溶液,其中上层呈黄色,下层呈紫色。
(3)向(2)所得溶液中加入AgNO3溶液,有白色沉淀生成。
(4)另取原溶液,调节pH使其呈中性后,加入适量的Na2S溶液,滤去产生的黑色沉淀;
在滤液中继续加碱至是强碱性,得白色沉淀;过滤后给滤液加热,有刺激性气味的气体
产生。
由此判断原溶液中一定有大量的 离子,没有 离子,不能确定有无 离子。
24.(7分)有A、B、C、D四种电解质,它们均由多种元素组成(元素的原子序数均小于20,相同浓度溶液的pH是A<B<C<D,且只有A的出小于7.0,四种物质的焰色反应皆显黄色,A与B、C、D都能反应,但仅B、C产生无色有酸味的气体,向A溶液中加入Ba(NO3)2溶液,能产生不溶于HNO3的白色沉淀。
试推断A、B、C、D的化学式,并写出B和D反应的离子方程式。
四、计算题
25.(6分)将7.8g Na2O2投到100g 10% NaOH溶液中,生成的溶液的密度为1.18g/cm3。
(1)试计算所得溶液的物质的量浓度;
(2)若向所得溶液中加入一定量的稀硫酸,然后把溶液蒸干所得固体重44.2g,试通过计算指出组成此固体的物质和质量。
26.(12分)今有碱金属的两种碳酸盐组成的混合物6.14g,加水溶解后,取所得溶液的十分
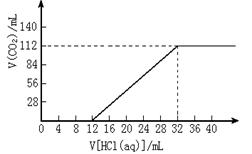 之一,向其中缓慢滴加一定浓度的盐酸,
之一,向其中缓慢滴加一定浓度的盐酸,
并同时记录放出CO2的体积(标准状况)
和消耗盐酸的体积,得到右图所示的曲线。
试计算:
(1)混合物中碳元素的质量分数。
(2)所滴加盐酸的物质的量浓度。
(3)确定这两种碱金属碳酸盐的化学式。
碱金属同步训练参考答案
一、二选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | C | B | C | C | C | C | B | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | A | B | D | B | D | A | A | BD | B |
19.
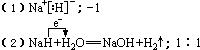
20.n2>m1>m2>n1
21.(1)②;白色固体变蓝色;带火星;复燃。
(2)未反应的二氧化碳与石灰水反应所致。
(3)由于生成氧气的量减少,E中可能会因二氧化碳与石灰水反应而倒吸。
(4)小;30;Na2O2可能含有其它杂质;D装置可能有氧气未被排出。
(5)不安全,不合理;乙。
22.(1)HCl Na2CO3 (2)CO32— + H+ =HCO3— HCO3—+ H+ =CO2↑+H2O
(3)0.8 1 (4)[0,8.96n]
23.NH4+、Mg2+、Fe2+、I- Ag+、NO3-、OH- Na+、Cl-、SO42-
24.A:NaHSO4 B:NaHCO3 C:Na2CO3 D:NaOH
反应式略
25.(1)5mol/L (2)固体为Na2SO4 14.2g,NaHSO4 30g
26.(1)9.77% (2)0.25mol/L (3)K2CO3、KHCO3
