2006年下期高三第一次月考化学试题
(时间90分钟 总分110分)
可能用到的原子量:H—1 S—32 O—16 Na—23
第Ⅰ卷(选择题 共54分)
一. 选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
1.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止富脂食品氧化变质,延长食品的保质期,在包装袋中常放入抗氧化剂物质。下列不属于抗氧化剂的为
A.生石灰 B.还原铁粉 C.Na2SO3 D.维生素C
2. 下列物质中,属于原子晶体的化合物是
A.水晶 B.金刚石 C.晶体硅 D.干冰
3.能证明胶体微粒比溶液中溶质微粒直径大的实验是
A.电泳 B.丁达尔现象 C.布朗运动 D.渗析
4.下列各组能源中,符合图中阴影部分的一组为

A.煤炭、石油、沼气 B.水能、生物能、燃气
C.太阳能、风能、潮汐能 D.地热能、海洋能、核能
5. 实现下列变化时,需克服相同类型作用力的是
A.石墨和干冰的熔化 B.食盐和冰醋酸的熔化
C.液溴和液汞的气化 D.纯碱和烧碱的熔化
6.若在加入铝粉能放出氢气的溶液中分别加入下列各组离子,可能共存的是
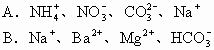
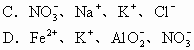
7.下列离子方程式正确的是
A.硫化亚铁放入盐酸中 S2-+2H+====H2S↑
B.硫酸铜溶液中通入硫化氢 Cu2++H2S====CuS↓+2H+
C.氯化铝溶液中加入过量氨水 Al3++4NH3·H2O====AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO![]() +OH-====CO
+OH-====CO![]() +H2O
+H2O
8.在硫酸的工业制法中,下列生产操作及说明生产操作的主要原因二者都正确的是
A.从沸腾炉出来的炉气需净化,因为炉气中![]() 会与杂质反应
会与杂质反应
B.硫铁矿燃烧前需要粉碎,因为大块的不能燃烧
C.![]() 用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使
用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使![]() 吸收完全
吸收完全
D.![]() 氧化为
氧化为![]() 时需要使用催化剂,这样可以提高
时需要使用催化剂,这样可以提高![]() 的转化率
的转化率
9. 碳化硅(SiC)的一种晶体,具有类似金钢石的结构,其中碳原子和硅原子的位置是交替的,在下列三种晶体:①金刚石②晶体硅③碳化硅中,它们的熔点由高到低的顺序是
A.②③① B.①③②
C.③①② D.②①③
10.将某溶液滴入![]() 溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是
溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是
A.![]() 溶液 B.
溶液 B.![]() NaOH溶液
NaOH溶液
C.![]() 溶液 D.硅酸溶胶
溶液 D.硅酸溶胶
11.下图装置中,a、b都是惰性电极,烧杯中为电解质溶液.通电一段时间后,a极附近呈红色.下列说法中正确的是
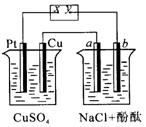
A.x是正极,y是负极 B.x是负极,y是正极
C.![]() 的溶液的pH减小
D.NaCl溶液的pH基本不变
的溶液的pH减小
D.NaCl溶液的pH基本不变
12.实验室制取少量N2常利用的反应是NaNO2+NH4Cl![]() NaCl+N2↑+2H2O,关于该反应的说法正确的是
NaCl+N2↑+2H2O,关于该反应的说法正确的是
A.NaNO2是氧化剂 B.生成1 mol N2时转移的电子数是6 mol
C.NH4Cl中的N元素被还原 D.N2既是氧化剂又是还原剂
13. 下列所述性质中能证明化合物微粒间一定存在离子键的是
A.易溶于水 B.具有较高的熔点
C.熔融状态下能导电 D.溶于水能电离出离子
14. 从下面的变化过程,推断氧化性由强到弱的顺序是
(1)![]() (2)
(2)![]()
(3)![]() (4)
(4)![]()
(5)![]()
A. ![]() B.
B.
![]()
C. ![]() D.
D. ![]()
15.用惰性电极电解下列各组中的三种电解质溶液,在电解过程中溶液pH依次升高、降低、不变的组是
A.![]() 、
、![]() 、
、![]() B.
B.![]() 、KOH、
、KOH、![]()
C.KBr、![]() 、
、![]() D.HCl、
D.HCl、![]() 、
、![]()
16.在25℃时,将两根铂电极插入一定量的硫酸钠饱和溶液中进行电解,当电路中有amol电子转移时,溶液中析出m g![]() 晶体.若温度不变,在剩余溶液中溶质的质量分数为
晶体.若温度不变,在剩余溶液中溶质的质量分数为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
17.G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的分子式或化学式,但知道它们在一定条件下具有如下的转换关系(未配平):
(1)G→Q十NaCl
(2)Y十NaOH→G十Q十H2O
(3)
![]() (4)Z十NaOH→Q十X十H2O
(4)Z十NaOH→Q十X十H2O
这五种化合物中氯的化合价由低到高的顺序为
A.QGZYX B.GYQZX C.GYZQX D.ZXGYQ
18.N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)====
O2(g)====![]() N2(g)+H2O(g);ΔH=+267 kJ·mol-1
N2(g)+H2O(g);ΔH=+267 kJ·mol-1
B.N2H4(g)+O2(g)====N2(g)+2H2O(l);ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH=+534 kJ·mol-1
D.N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH=-534 kJ·mol-1
第II卷(选择题 共56分)
二、(本题包括1小题,共14分)
19.用上图装置进行实验,回答有关问题:
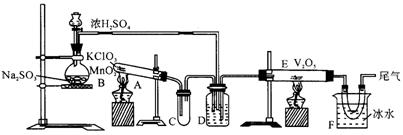
(1)玻璃管E内发生反应的化学方程式______________________________.
(2)小试管C的作用______________________________________________.
(3)广口瓶D内盛的试剂是________.
(4)从管E中导出的气体成分是________.
(5)装置F中U型管所收集的物质颜色、状态是________.
(6)若U型管内收集到的物质很少,分析其原因,不可能的是(填标号)________.a.装置气密性不好;b.制得的![]() 中混有少量
中混有少量![]() 杂质使催化剂中毒;c.气流速度过快.
杂质使催化剂中毒;c.气流速度过快.
(7)从U型管导出的尾气的处理方法是________________.
三、(本题包括2小题,共31分)
20.(7分)某溶液中含有X-、Y2-、Z2-三种常见的无机离子。如下面框图所示,发生了一系列化学反应。
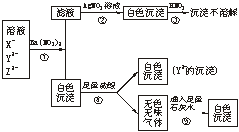
(1)判断X-、Y2-、Z2-分别为_________、_________、_________。(写离子符号)
(2)写出①②④⑤步反应的离子方程式。
①________________________________________________;
②________________________________________________;
④________________________________________________;
⑤________________________________________________。
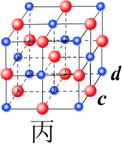
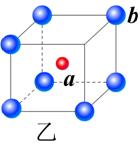
21.(6分)现有甲、乙、丙(如下图)三种晶体,可推知甲晶体的化学式为
乙晶体的化学式为 丙晶体中c与d的个数比为
22.(8分)通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ KJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
 ⑴ 比较下列两组物质的熔点高低
(填>或<)
⑴ 比较下列两组物质的熔点高低
(填>或<)
SiC______ Si; SiCl4 ______ SiO2
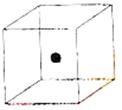
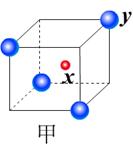
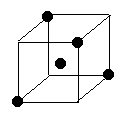
⑵ 右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶ 工业上高纯硅可通过下列反应制取:
SiCl4 (g) + 2H2(g) ![]() Si(s) + 4HCl(g)
Si(s) + 4HCl(g)
该反应的反应热△H = ___________ KJ/mol
23.(10分)已知在pH为4~5的环境中,![]() 几乎不水解,而
几乎不水解,而![]() 已完全水解,转化为
已完全水解,转化为![]() 。某同学欲提纯含有少量
。某同学欲提纯含有少量![]() 和稀
和稀![]() 的
的![]() 溶液,并利用电解纯净的
溶液,并利用电解纯净的![]() 溶液得到的数据,计算Cu的相对原子质量。
溶液得到的数据,计算Cu的相对原子质量。
(1)向含有少量![]() 和稀
和稀![]() 的
的![]() 溶液中,加入稍过量的黑色粉末A搅拌、过滤,得到较纯净的
溶液中,加入稍过量的黑色粉末A搅拌、过滤,得到较纯净的![]() 溶液。A的化学式为___________,加入A的作用是_________________________________________________________________;
溶液。A的化学式为___________,加入A的作用是_________________________________________________________________;
(2)将较纯净的![]() 溶液放入下图所示的装置中进行电解,
溶液放入下图所示的装置中进行电解,
石墨电极上的电极反应式为_______________________________________________,
电解反应的离子方程式为_________________________________________________;
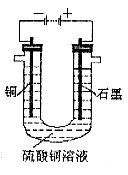
(3)实验完成后,石墨电极产生标准状况下的气体V mL,铜电极增重a g,则Cu的相对原子质量(用带有a、V的计算式表示)为________________________________。
四、(本题包括1小题,共11分)
24. (11分)
氯酸钾 与50
mL浓盐酸在一定温度下反应会生成黄绿色的易爆物ClO2,反应的化学方程式为(未配平):KClO3+HCl![]() KCl+Cl2↑+ClO2↑+H2O
KCl+Cl2↑+ClO2↑+H2O
(1)配平上述反应的化学方程式:____________。
(2)浓盐酸在反应中显示出来的性质是_________(填写编号,多选倒扣分)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)若产生0.1 mol Cl2,则转移电子的物质的量为_________ mol。
(4)若反应中HCl的利用率只有50%,当产生黄绿色的气体4.2升(标况)时,求浓盐酸的物质的量浓度?
 祁阳二中2006年下期高三第一次月考
祁阳二中2006年下期高三第一次月考
化学试题答题卡
|
第Ⅰ卷(选择题 共54分)
一、选择题(本题包括18小题,每小题3分,共54分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(非选择题 共56分)
|
|
2006年下学期祁阳二中高三第一次月考化学参考答案
1D 2A 3B 4C 5D 6C 7B 8C 9B 10A 11B 12A 13C 14C 15C 16D 17B 18D
19.(1)E管内的反应为:![]()
(2)小试管C的作用应是安全瓶,目的是防止倒吸.
(3)广口瓶D内盛放的试剂是浓![]() .
.
(4)因为(1)反应为可逆反应,所以从管E导出的气体中含有![]() 、
、![]() 、
、![]() .
.
(5)F装置为冰水冷却装置,所得物质为无色晶体![]() .
.
(6)不可能的应是b.
(7)尾气中含有![]() ,所以应用NaOH溶液吸收.
,所以应用NaOH溶液吸收.
20. 答案:(1)Cl- SO![]() CO
CO![]() (2分)
(2分)
(2)①Ba2++SO![]() ====BaSO4↓ (2分)Ba2++CO
====BaSO4↓ (2分)Ba2++CO![]() ====BaCO3↓(2分)
====BaCO3↓(2分)
②Ag++Cl-====AgCl↓(2分) ③无 ④BaCO3+2H+====Ba2++CO2↑+H2O(2分)
 ⑤CO2+Ca2++2OH-====CaCO3↓+H2O(2分)
⑤CO2+Ca2++2OH-====CaCO3↓+H2O(2分)
21.甲:X2Y或YX2;乙:ab或ba;丙:1:1
22.(1)> ;< ⑵
(3)+236
23. (1)![]() (2分) 调节溶液pH至4~5,除去
(2分) 调节溶液pH至4~5,除去![]() (2分)(答降低溶液酸度,除去
(2分)(答降低溶液酸度,除去![]() 可得分)
可得分)
(2)![]() (2分)
(2分)
![]() (2分)(不配平、条件错误不得分)
(2分)(不配平、条件错误不得分)
(3)![]() (2分)
(2分)
24.(1)2.4.2.2.1.2
(2)② (3)0.2
(4) 10mol/L