永州一中高三第一次月考化学试题
命题人:邓华林 审题人:唐和秀
时量:90分钟 满分:110分
可能用到的相对原子质量:H-1 O-16 S-32 Na-23 Fe-56 Cu-64 Zn-65 Ag-108
第I卷(选择题共48分)
一、选择题:本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意.
1.生活中的问题常涉及化学知识,下列过程不涉及化学变化的是
A.用食醋或醋精除去暖瓶内的水垢 B.用四氯化碳擦去圆珠笔油渍
C.用糯米饭、酒曲等自制甜酒酿 D.用75%的乙醇溶液进行皮肤消毒
2.下列叙述正确的是
A.强电解质都是离子化合物,因此NaCl是离子化合物 B.醋酸溶液的导电能力可能比稀硫酸强
C.SO3溶于水,其水溶液能导电,SO3是电解质 D.硫磺是单质,不导电,因此硫磺是非电解质
3.下列化工生产过程中所发生的反应不属于氧化还原反应的是
A.用油脂制肥皂 B.用铝土矿制金属铝 C.用氯气和消石灰制漂白 D.用氢气和氮气合成氨
4.为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,将粗盐溶于水,然后进行下列操作:①过滤②加足量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液,合理的操作顺序是
A.④⑤②①③ B.②⑤④③① C.⑤②④①③ D.①④②⑤③
5.共价键不可能出现在:①单质中 ②金属晶体中 ③原子晶体中 ④离子晶体中
A.② B.②③ C.②④ D.①②③④
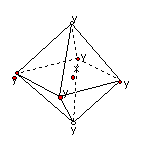 6.在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图)。该晶体可能为
6.在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图)。该晶体可能为
A.NaCl B.CsCl C.CO2 D.SiO2
7.“纳米技术”广泛的应用于催化及军事科学中,“纳米技术”是指粒子直径在几纳米到几十纳米的材料。如将“纳米材料”分散到液体分散剂中,所得的混合物具有的性质是
A.能全部通过半透膜 B.能发生丁达尔现象 C.一定能导电 D.一定为悬浊液或乳浊液
8.下列离子方程式表示错误的是
A.等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合: HCO3- + Ba2+ + OH-== BaCO3↓ + H2O
B.Fe2O3溶于过量氢碘酸溶液中: Fe2O3 + 6H+ + 2I-== 2Fe2+ + I2 +3H2O
C.三氯化铁浓溶液滴入沸水中,制取氢氧化铁胶体: Fe3+ + 3H2O = Fe(OH)3↓ + 3H+
D.铜片加入稀硝酸中: 3Cu +2NO3- + 8H+== 3Cu2+ + 2NO↑ + 4H2O
9.已知在1.01×105Pa、298K条件下,2molH2燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A.H2O(g)==H2(g) + 1/2O2(g);△H = - 242kJ/mol
B.2H2(g) + O2(g)==2H2O(I);△H = - 484kJ/mol
C.2H2(g) + O2(g)==2H2O(g);△H = + 484kJ/mol
D.H2(g) + 1/2O2(g)==H2O(g);△H = - 242kJ/mol
10.某无色透明溶液中,由水电离出来的c(H+) = 1×10-13mol/L,在该溶液中一定能够大量共存的离子组是
A. Fe3+、A13+、Cl-、HS- B.K+、Na+、SO42-、NO3-
C.NH4+、A1O2-、Na+、CH3COO- D.K+、Na+、MnO4-、NO3-
11.下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是
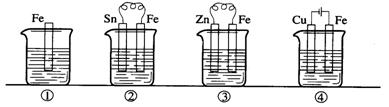
A.④>②>①>③ B.②>①>③>④ C.④>②>③>① D.③>②>④>①
12.用惰性电极实现电解,下列说法正确的是
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
13.在2KNO3 + S + 3C===K2S + N2↑ + 3CO2↑的反应中,被2molKNO3氧化的C的质量是
A.15g B.18g C.21g D.30g
14.在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2+ + 2e→Cu或Ag+ + e→Ag在电极上放
电,若析出铜的质量为1.92g,则析出银的质量为
A.1.62g B.3.24g C.6.48g D.12.96g
15.接触法制硫酸生产过程中,假如进入接触室的原料气为100m3,反应后体积减少为92m3,
已知原料气中SO2、O2、N2的体积比为20:15:65,则SO2的转化率为
A.60% B.70% C.80% D.90%
16.多硫化钠Na2Sx(X≥2)在结构上与Na2O2,FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原为NaCl反应中,Na2Sx与NaClO的物质的量之比为1:16,则X值是
A.2 B.3 C.4 D.5
第I卷答题卡(选择题共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]()
 第II卷(非选择题共62分)
第II卷(非选择题共62分)
二、(本题包括4小题,共20分)
17.(4分)有下列几种晶体:①冰;②金刚石;③氯化钠;④干冰;,其熔点由低到高的顺序
是(填序号) 。
18.(6分)在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量的情况,解决的方法是将
陶土和水一起搅拌,使微粒直径处于10-9~10-7m之间,然后插入两根电极,接通直流电源,
这时阳极聚集 ,阴极聚集 ,理由
是 。
19.(4分)配平氧化还原反应方程式,
(1) NH3+ NO2→ N2+ H2O
(2)氧化产物与还原产物的质量比为 。
20.(6分)(1)室温下,将2g苯(C6H6)完全燃烧生成液态水和CO2,放出83.6kJ的热量,
写出C6H6燃烧热的热化学方程式 。
(2)若lg水蒸汽转化成液态水放热2.44kJ,则室温下1molC6H6完全燃烧生成气态水时放出
的热量为 。
三、(本题包括2小题,共18分)
21.(10分) 中和热测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器
要尽量做到绝热;在量热的过程中要尽量避免热量的散失,比较准确地测量出反应前后溶
液温度的变化。回答下列问题:
(1)中学化学实验中的中和热的测定所需的玻璃仪器除烧杯和温度计外还有:
;
(2)该实验常用0.50mol·L-1HCl和0.55mol·L-1的NaOH溶液各50mL。NaOH的浓度大于
HCl的浓度其原因是 。当室温低于10℃时进行,对实
验结果会造成较大的误差的主要原因是 。
(3)若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容
C=4.18J/(g·℃),则该中和反应放出热量为 kJ(填表达式),
ΔH= kJ/mol(填表达式)。
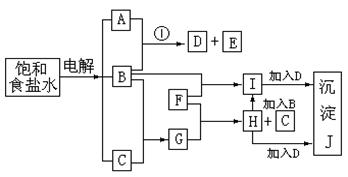
22.(8分)下图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物(反应
时加入或生成的水,以及生成沉淀J时的其他产物均已略去)。
请填写下列空白:
(1)物质B是 ,G是 ,J是 。(填化学式)
(2)反应①的离子方程式是
。
四、(本题包括2小题,共24分)
23.(11分)硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 的
郊区(填选项的标号)。
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.人口稠密的文化、商业中心城市 D.消耗硫酸甚多的工业城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t 98%硫酸需消耗
![]() 3.6×105kJ能量,若反应:SO2(g) + 1/2O2(g)
SO3(g);△H=-98.3kJ·mol-1
3.6×105kJ能量,若反应:SO2(g) + 1/2O2(g)
SO3(g);△H=-98.3kJ·mol-1
放出的热量能在生产过程中得到充分利用,则每生产1t98%硫酸可向外界输出
kJ能量。
(3)若1g含SiO2和FeS2的某硫铁矿样品,在氧气中充分燃烧,残余固体质量为0.84g,
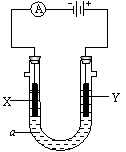 则这种矿石100t,可以制得98%的H2SO4质量为
t。
则这种矿石100t,可以制得98%的H2SO4质量为
t。
24.(13分)电解原理在化学工业中有广泛应用。右图表示一个电解池,
装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
(1) 若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,
同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。
在X极附近观察到的现象是 。
②Y极上的电极反应式为 ,
检验该电极反应产物的方法是
(2)如果X极为铁,Y为含杂质锌均匀的粗铜,电解液a为CuSO4溶液,通电一段时间
后,切断电源,立即将电极取出,这时铁极上析出3.52g铜,电解液增重0.01g 。求粗铜
中锌的质量分数。
参考答案
第I卷答题卡(选择题共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | B | B | A | C | A | A | B | C | D | B | A | D | D | C | C | D |
第II卷(非选择题共62分)
17.(4分)④①③②
18.(6分每空2分)带负电的陶土胶粒,带正电的氧化铁胶粒,通直流电时发生了电泳。
19.(4分每空2分)(1) 8NH3+6NO2 == 7N2+12H2O (2)4:3
20.(6分每空3分)C6H6(1)+15/2O2(g)===3H2O(l)+6CO2(g);△H=-3260.4kJ/mol,3128.64kJ。
21.(10分每空2分)(1)量筒、环形玻璃搅拌棒;(2)保证盐酸完全被中和;散热太快;
![]() (3)0.418(t2-t1); -0.418(t2-t1)/0.025
(3)0.418(t2-t1); -0.418(t2-t1)/0.025
22.(8分每空2分)(1)Cl2, HCl,Fe(OH)3 (2) Cl2 +2OH-=ClO-+Cl-+H2O
23.(11分)(1)D(3分) (2) 6.23×105 (4分) (3)80(4分)
24.(13分)
⑴①2H+ + 2e - = H2↑(2分) 放出气体,溶液变红。(2分)
②2Cl - - 2e - = Cl2 ↑ (2分) 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。(2分)
⑵(5分) X极上反应为:Cu2+ + 2e - = Cu Y极上反应为:Zn – 2e- = Zn2+ Cu - 2e - = Cu2+
![]() n(Cu)×64g/mol
+n(Zn)×65g/mol-3.52g=0.01g
n(Cu)×64g/mol
+n(Zn)×65g/mol-3.52g=0.01g
依题意有:
2[n(Cu)+n(Zn)] =2×3.52g/64g·mol-1
解得:n(Cu)=0.045mol n(Zn)=0.01mol
![]()
参考答案
第I卷答题卡(选择题共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | B | B | A | C | A | A | B | C | D | B | A | D | D | C | C | D |
第II卷(非选择题共62分)
17.(4分)④①③②
18.(6分每空2分)带负电的陶土胶粒,带正电的氧化铁胶粒,通直流电时发生了电泳。
19.(4分每空2分)(1) 8NH3+6NO2 == 7N2+12H2O (2)4:3
20.(6分每空3分)C6H6(1)+15/2O2(g)===3H2O(l)+6CO2(g);△H=-3260.4kJ/mol,3128.64kJ。
21.(10分每空2分)(1)量筒、环形玻璃搅拌棒;(2)保证盐酸完全被中和,散热太快;
![]() (3)0.418(t2-t1); -0.418(t2-t1)/0.025
(3)0.418(t2-t1); -0.418(t2-t1)/0.025
22.(8分每空2分)(1)Cl2, HCl,Fe(OH)3 (2) Cl2 +2OH-=ClO-+Cl-+H2O
23.(11分)(1)D(3分) (2) 6.23×105 (4分) (3)80(4分)
24.(13分)
⑴①2H+ + 2e - = H2↑(2分) 放出气体,溶液变红。(2分)
②2Cl - - 2e - = Cl2 ↑ (2分) 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。(2分)
⑵(5分) X极上反应为:Cu2+ + 2e - = Cu Y极上反应为:Zn – 2e- = Zn2+ Cu - 2e - = Cu2+
![]() n(Cu)×64g/mol
+n(Zn)×65g/mol-3.52g=0.01g
n(Cu)×64g/mol
+n(Zn)×65g/mol-3.52g=0.01g
依题意有:
2[n(Cu)+n(Zn)] =2×3.52g/64g·mol-1
解得:n(Cu)=0.045mol n(Zn)=0.01mol
![]()