得胜中学高三化学第一章单元测验
(满分100分,时间100分钟)
1、将反应Mn2+ + BiO3-
+ H+![]() MnO4- + Bi3+ + H20配平后,H+的化学计量数为( )
MnO4- + Bi3+ + H20配平后,H+的化学计量数为( )
A、8 B、10 C、14 D、30
2、在3Cl2 +8NH3 =6NH4Cl +N2 反应中,还原性最强的物质是( )
A、Cl2 B、NH3 C、NH4Cl D、N2
3、在反应KI +5KIO3 +3H2S =3I2 +3K2SO4 +3H2O 中,被氧化的碘元
素和被还原的碘元素的质量比是 ( )
A、1:5 B、5:1 C、6:1 D、1:6
4、下列变化中,需加入氧化剂才能进行的是 ( )
A、Br―→Br2 B、Cr2O72―→Cr3+ C、S2―→HS―D、NO3―→NO
5、在xR2+ +y H+ +O2 =m R3++n H2O 的离子反应中,m 的值为 ( )
A、2x B、4 C、y/2 D、4n
6、有一不纯的铝样品中含有硅和铁两种杂质,现取两份等质量的样品分
别与足量的盐酸、氢氧化钠溶液反应,充分反应后生成等质量的气体。
已知在常温下,硅可与强碱溶液反应生成硅酸盐和氢气。则此不纯的
铝样品中含铁和硅的质量之比为 ( )
A.4:1 B.2:1 C.3:1 D.1:1
7、10.将KCl和CrCl3两种固体混合物共熔制得化合物X,X由K、Cl、
Cr元素组成。将1.892gX中Cr元素全部氧化成Cr2O72-, Cr2O72-可过
量的KI中氧化出2.667g I2,反应离子方程式是:
Cr2O72-+6I-+14H+=2Cr3++3 I2+7H2O,如果取溶有1.892g X的溶
液,加入过量的AgNO3,可得4.52g AgCl沉淀,则表示X组成的化学
式为 ( )
A K3Cr2Cl7 B K3Cr2Cl5 C K3Cr2Cl9 D K2CrCl4
8、已知(1)硫酸铜 + 碳酸钠:主要反应Cu2+ + CO32- + H2O=Cu(OH)2↓+CO2
次要反应:Cu2+ + CO32- =CuCO3↓ (2)硫酸铜+硫化钠:
主要 Cu2+ + S2- =CuS↓次要反应:Cu2+ + 2OH- = Cu(OH)2↓+ H2S下列
几种物质溶解度大小比较正确的是( )
A、Cu(OH)2>CuCO3>CuS B、Cu(OH)2<CuCO3<CuS
C、CuS >Cu(OH)2>CuCO3 D、CuS <Cu(OH)2<CuCO3
9、有FeSO4、Fe2(SO4)3、CuSO4的混合溶液600mL,其中c(SO42-) = 0.1mol·L-1
投入一些锌粉,反应后得到一些固体沉淀,经测定沉淀中含有Cu、Fe,
但不含Zn,溶液中还有0.01molFe2+离子。据此可知投入的锌粉质量是 ( )
A、13g B、9.75g C、6.5g D、3.25g
10、能共存于同一溶液中,加入少量氢氧化钠溶液有沉淀生成,加入少
量盐酸也有沉淀生成的是 ( )
A、K+ Fe3+ NO3- SiO32- B、HCO3- Cl- Ba2+ Na+
C、Ag+,H2PO4- NO3- K+ D、Al3+ AlO2- Cl- Na+
11、下列说法正确的是 ( )
A、凡是难溶于水的化合物都是弱电解质
B、凡是易溶于水的化合物都是强电解质
C、在弱电解质溶液中,弱电解质分子与其电离出的离子共存
D、任何强酸和强碱在溶液中发生中和反应时,都可用离子方程式
H++OH― =H2O 表示
12、能用Cu2++S2― =CuS↓ 表示的化学反应是 ( )
A、硫酸铜溶液和氢硫酸反应 B、氢氧化铜和硫化钾溶液反应
C、氯化铜溶液和硫化钠溶液反应 D、氢氧化铜和氢硫酸反应
13、下列离子方程式中错误的是 ( )
A、铁跟稀硫酸反应 Fe+2H+==Fe2++H2↑
B、碳酸氢钙溶液与稀盐酸反应2H++CO32― ==H2O+CO2↑
C、醋酸与氢氧化钾溶液 CH3COOH+OH-==CH3COO―+H2O
D、碳酸镁跟硫酸反应 MgCO3+2H+==Mg2++H2O+CO2↑
14、NaHCO3 和NaHSO4 的稀溶液混合,实际参加反应的离子是 ( )
A、H+和CO32― B、HCO3―和HSO4―C、HCO3―和SO42― D、HCO3―和H+
![]() 15、已知下列两个热化学方程式:
15、已知下列两个热化学方程式:
![]()
实验测知氢气和丙烷的混合气体有5mol,完全燃烧时放热3847kJ,
则混合气体中氢气与丙烷的体积比是 ( )
A.1:3 B.3:1 C.1:4 D.1:1
16、已知:CH4(气)+2O2(气)=CO2(气)+2H2O(液);ΔH=-Q1;
2H2(气)+O2(气)=2H2O(气);ΔH=-Q2;
2H2(气)+O2(气)=2H2O(液);ΔH=-Q3。常温下取体积比4:1的甲烷和
氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常
温,则放出的热量为 ( )
A.0.4Q1+ 0.05Q3 B. 0.4 Q1+0.05Q2
C. 0.4 Q1+ 0.1Q3 D. 0.4 Q1+0.2Q2
根据下列叙述回答4—6题
能源可划分为一级能源和二级能源。自然界中以现成形式提供的能
源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级
能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中
大量存在的水来制取:2H2O(液)=2H2(气)+O2(气);ΔH=+517.6kJ/mol
17、下列叙述正确的是 ( )
A.电能是二级能源 B.水力是二级能源
C.天然气是二级能源 D.焦炉气是一级能源
18、已知2H2(气)+O2(气)=2H2O(液);ΔH=-571.6kJ/mol 。CH4(气)+2O2(气)=2H2O(液)+CO2(气);ΔH=- 890.3kJ/mol 。1g氢气
和1g甲烷分别燃烧后,放出热量之比最接近 ( )
A.1:3.4 B. 1:1.7 C.2.5:1 D.4.6:1
19、关于用水制取二级能源氢气,以下研究方法不正确的是 ( )
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解
的情况下,使氢成为二级能源,这种说法是错误的
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源,以分解水制氢气
20、已知298K时2SO2(g)+O2(g)==2SO3(g);ΔH=-197kJ/mol。在相同温
度下,向密闭容器中通入2molSO2和1molO2达到平衡时放出热量Q1;
向另一相同体积的密闭容器中通入1molSO2 和0.5molO2.达到平衡时
放出热量Q2 ,则下列关系式正确的是 ( )
A.Q2=Q1/2 B.Q2>Q1/2 C.Q2<Q1<197kJ D.Q1=Q2<197Kj
第二卷 非选择题
21、(7分)某河道两旁有甲乙两厂,它们排放的工业废水中共含K+、Fe3+、
Ag+、NO3-、Cl-、OH-六种离子。甲厂的废水明显显碱性,故甲厂废水
中所含的三种离子是____、_____、_____。乙厂的废水中含有另三
种离子为 、 、 。如果加一定量__________(选
填:“活性炭”、“硫酸亚铁”、“铁粉”),可以回收其中的金
属___________(填写元素符号)。另一种设想是将甲厂和乙厂的废
水按适当的比例混合,可以使废水中的_____(填写离子符号)转化
为沉淀,经过滤后的废水中主要含有__________,可用来灌溉农田。
答案:(OH-、K+、Cl-; Fe3+、Ag+、NO3- ; Fe ; Ag ;
Fe3+、Ag+、OH-、Cl-; K+、NO3-)
22、(5分)已知多元弱酸在水溶液中的电离是分步进行的,且第一步
电离程度远大于第二步,第二步电离程度远大于第三步……,现有HA、
H2B、H3C三种一元、二元、三元酸,它们之间能发生如下反应:
HA + HC2-(少量)== A- + H2C-
2A- + H2B(少量)==2HA + B2-
H2C- + H2B(少量)==H3C + HB-
根据“较强酸 + 较弱酸盐 == 较弱酸 + 较强酸盐”的规律,回答下
列问题:
⑴在相同条件下,HA、H2B、H3C三种酸中酸性最强的是______ ______。
⑵A-、B2-、C3-、HB-、HC2-、H2C-六种离子中,最易结合质子(H+)的是
______________,最难结合质子(H+)的是______________。
⑶写出下列反应的离子方程式:
H3C + OH-(过量) == _______________________________________ 。
HA(过量) + C3- == _______________________________________。
答案:(①H2B ②C3+、HB- ③H3C+3OH-=C3-+3H2O 2HA+C3-=H2C-+2A-
23、(14分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐
滴加入到固体B 中,回答下列问题:
⑴图中D装置在实验中的作用是 .
⑵若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶
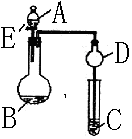 液,旋开E后,C中的现象为
,
液,旋开E后,C中的现象为
,
C中发生反应的化学方程式为 。
⑶若A为浓盐酸,B为KMnO4,C中盛有KI淀
粉溶液,旋开E后,C中的现象是 ;
继续通气体于C 中,足够长的时间后,发现C中
溶液的颜色消失,这 是因为在溶液中I2能被Cl2
氧化为HIO3,写出该反应的化学方程式 。
⑷若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长
的时间后,C中的现象是 ,C中发生反应的离子方程式
为 。
⑸该题图示装置有多种用途,请举一例(除题中之外)填空:
A为 ,B为 ;C中盛 ,
其目的为 。
答案:(1)防止溶液倒吸
(2)溶液中出现淡黄色浑浊;2H2S+O2=2S↓+2H2O
(3)溶液由无色变蓝;5Cl2+I2+6H2O=2HIO3+10HCl
(4)产生白色胶状沉淀;Al3++3NH3·H2O=Al(OH)3↓+3NH+4(以
上方程式每空2分,其余每空1分)
(5)A中盛有浓硫酸、B中盛有Na2SO3、C中盛有品红溶液;检
验SO2能否使品红褪色。(每空1分)
24、(6分)Cl2 和NH3 能发生下列反应:3Cl2+8NH3=6NH4Cl+N2 。
⑴该反应中氧化剂是 ,还原剂是 。被氧化的NH3 占
参加反应的NH3的 ;氧化剂与作还原剂物质的分子个数比
为
⑵若有6.8g NH3 参加了反应,则被氧化的NH3 为 g,生成
氧化产物 g。
答案:Cl2;NH3;25%;3:2;1.7;1.4
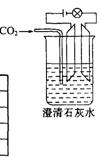 25、( 8 分)已知 Ca
25、( 8 分)已知 Ca![]() 、 CaCO3和 Ca
、 CaCO3和 Ca![]() 都是电解质,根据溶液的导电能力,实验装置如图,将实验现象填在下面的空格中。
都是电解质,根据溶液的导电能力,实验装置如图,将实验现象填在下面的空格中。
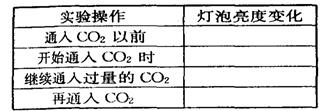
答案:亮;变暗直至几乎熄灭;变亮;不变
26、(8分)已知硫酸锰(MnSO4)和过硫酸钾( K2S2O8)两种盐溶液在
银离子催化下可发
生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
⑴请写出并配平上述反应的化学方程式 ;
⑵此反应的还原剂是 ;它的氧化产物是 ;
⑶此反应的离子方程式 ;
⑷若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应
时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还
有 。
答案:⑴2MnSO4 + 5K2S2O8 + 8H2O =4K2SO4 +2KMnO4+8H2SO4
⑵MnSO4 KMnO4
⑶参照方程式
⑷Cl2
27、(12分)观察实验,根据实验现象回答问题。某学校元旦晚会上,主
持人用手枪式喷雾器向一张“白”纸喷出一种未知溶液,便在白纸上
出现“努力学习”四个黑字。这时主持人再向白纸喷出H2O2水雾,
结果黑色字迹消失,同时出现“迎接挑战”四个蓝色字体。(已知“努
力学习”四个字是事先用 Pb![]() 溶液写好的。)
溶液写好的。)
⑴第一次喷出的溶液一定含有 离子。
⑵喷出的H202使“努力学习”四个字隐去,同时又出现“迎接挑战”四个字,其原因是
;
⑶使“努力学习”四个黑字出现的有关反应的离子方程式是
⑷该过程中涉及的氧化还原反应的化学方程式是:
。
答案:S2- ;双氧水将硫化铅氧化成白色的硫酸铅,而事先纸上有淀粉和碘化钾
双氧水将I-氧化成I2; Pb2+ + S2- =PbS; PbS+4H2O2=PbSO4 +4H2O
2KI + H2O2 = 2KOH + I2