存瑞中学2006----2007学年第一学期第一次月考
高三化学试题
可能用到的数据:H 1 C 12 O 16 S 32 Fe 56 N 14 Na 23 K 39 Ag 108 Cl 35.5 Zn 65 Cu 63.5 Mg 24 Ca 40
Ⅰ卷(60分)
一、选择题(每题只有一个答案符合题意,每题三分)
1、下列反应中硫酸既表现了氧化性,又表现了酸性的有( )
A.![]()
B.![]()
C. ![]()
D. H2SO4+Na2SO3![]() Na2SO4+H2O+SO2
Na2SO4+H2O+SO2![]()
2、下列反应中,属非氧化还原反应的是 ( )
A.3CuS+8HNO3![]() 3Cu(NO3)2+2NO↑+3S↓+4H2O
3Cu(NO3)2+2NO↑+3S↓+4H2O
B.3Cl2+6KOH![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
C.3H2O2+2KCrO2+2KOH![]() 2K2CrO4+4H2O
2K2CrO4+4H2O
D.3CCl4+K2Cr2O7![]() 2CrO2Cl2+3COCl2+2KCl
2CrO2Cl2+3COCl2+2KCl
3、某强氧化剂![]() 被亚硫酸钠还原到较低价态。如果还原2.4×10-3
mol
被亚硫酸钠还原到较低价态。如果还原2.4×10-3
mol ![]() 的溶液到较低价态,需用30 mL 0.2 mol·L-1的Na2SO3溶液,那么X元素的最终价态为 ( )
的溶液到较低价态,需用30 mL 0.2 mol·L-1的Na2SO3溶液,那么X元素的最终价态为 ( )
A.+2 B.+1 C.0 D.-1
4、下列离子方程式正确的是( )
A.硫化钠和稀硫酸反应Na2S+2H+![]() H2S↑+2Na+
H2S↑+2Na+
B.氢氧化钡溶液和稀硫酸反应![]()
C.氯气与水反应Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
D.亚硫酸钡与盐酸反应BaSO3+2H+![]() Ba2++SO2↑+H2O
Ba2++SO2↑+H2O
5、在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、
硫酸铜和硫酸铁溶液,这种试剂是( )
A.NaOH B.NH3 · H2O C.AgNO3 D.BaCl2
6、甲、乙两个电解池均为Pt为电极,且互相串联。甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液。通电一段时间后,测得甲池电极质量增加2.16g乙池电极上析出0.64 g金属,则乙池中的溶质可能是( )
A.CuSO4 B.MgSO4 C.Al(NO3)3 D.Na2SO4
7、下列各组离子一定能大量共存的是( )
A.在含大量Fe3+的溶液中:![]() 、Na+、Cl-、SCN-
、Na+、Cl-、SCN-
B.在强碱溶液中:Na+、K+、![]() 、
、![]()
C.在c(H+)=10-13
mol·L-1的溶液中![]() 、Al3+
、Al3+ ![]() 、
、![]()
D.在pH=1的溶液中:K+、Fe2+、Cl-、![]()
8、将一小块钠投入少量CaCl2的饱和溶液中,发生的现象是( )
A.析出银白色固体 B.剧烈反应,有气体生成
C.无色溶液中出现白色沉淀 D.溶液澄清无明显变化
9、用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液的pH下降的是( )
A.AgNO3 B.HNO3 C.NaOH D.Na2SO4
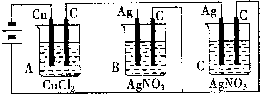 10、A、B、C三个电解槽,如图所示(其中电极的大小、形状、间距均相同)B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加0.128 g时,B中电极上银的质量增加( )
10、A、B、C三个电解槽,如图所示(其中电极的大小、形状、间距均相同)B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加0.128 g时,B中电极上银的质量增加( )
A.0.054 g B.0.108 g C.0.216 g D.0.432 g
11、下列热化学方程式中的反应热下划线处表示燃烧热的是( )
A.NH3(g)+![]() O2(g)
O2(g)![]() NO(g)+
NO(g)+![]() H2O(g);ΔH=-a kJ·mol-1
H2O(g);ΔH=-a kJ·mol-1
B.C6H12O6(s)+6O2(g)![]() 6CO2(g)+6H2O(l);ΔH=-b
kJ·mol-1
6CO2(g)+6H2O(l);ΔH=-b
kJ·mol-1
C.2CO(g)+O2(g)![]() 2CO2(g);ΔH=-c
kJ·mol-1
2CO2(g);ΔH=-c
kJ·mol-1
D.CH3CH2OH(l)+![]() O2(g)
O2(g)![]() CH3CHO(l)+H2O(l);ΔH=-d
kJ·mol-1
CH3CHO(l)+H2O(l);ΔH=-d
kJ·mol-1
12、已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l);
ΔH=-4b kJ·mol-1
4CO2(g)+2H2O(l);
ΔH=-4b kJ·mol-1
B.C2H2(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+H2O(l);
ΔH=2b kJ · mol-1
2CO2(g)+H2O(l);
ΔH=2b kJ · mol-1
C.2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l);
ΔH=-2b kJ·mol-1
4CO2(g)+2H2O(l);
ΔH=-2b kJ·mol-1
D.2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l);
ΔH=b kJ·mol-1
4CO2(g)+2H2O(l);
ΔH=b kJ·mol-1
13、下列关于反应热的叙述正确的是 ( )
A.当ΔH<0时,表示该反应为吸热反应
B.由C(s)+1/2O2(g)![]() CO(g)的反应热为110.5 kJ·mol-1,可知碳的燃烧热为110.5 kJ·mol-1
CO(g)的反应热为110.5 kJ·mol-1,可知碳的燃烧热为110.5 kJ·mol-1
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应放出的热量:CH3COOH<HNO3
14、将一定量的钠、铝合金置于水中,合金全部溶解,得到20ml、pH=14的溶液.然后用1mol/L的盐酸滴定至沉淀量最大时,消耗盐酸40ml。原合金中钠的质量为
A.0.92g B.0.69g C.0.64g D.0.23g
15、已知热化学反应方程式:Zn(s)+![]() O2(g)
O2(g)![]() ZnO(s);ΔH=-351.5 kJ·mol-1;
ZnO(s);ΔH=-351.5 kJ·mol-1;
Hg(l)+![]() O2(g)
O2(g) ![]() HgO(s);ΔH=-90.84 kJ·mol-1,则锌汞电池中热化学反应方程式:Zn(s)+HgO(s)
HgO(s);ΔH=-90.84 kJ·mol-1,则锌汞电池中热化学反应方程式:Zn(s)+HgO(s) ![]() ZnO(s)+Hg(l)的ΔH为( )
ZnO(s)+Hg(l)的ΔH为( )
A.、ΔH=+260.7 kJ·mol-1 B、.ΔH=-260.7 kJ·mol-1
C、.ΔH=-444.2 kJ·mol-1 D.、ΔH=+444.2 kJ·mol-1
16、接触法制硫酸的沸腾炉出来的炉气必须经过净化处理,其正确过程是 ( )
A.洗涤、干燥、除尘 B.干燥、除尘、洗涤
C.除尘、洗涤、干燥 D.除去硒和砷的化合物
17、已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为H2O2<Cl-<Fe2+<I-<SO2,则下列反应不能发生的是…( )
A.2Fe3++SO2+2H2O![]() 2Fe2++
2Fe2++![]() +4H+ B.I2+2H2O+SO2
+4H+ B.I2+2H2O+SO2![]() H2SO4+2HI
H2SO4+2HI
C.H2O2+H2SO4![]() SO2+O2↑+2H2O D.2Fe3++2I-
SO2+O2↑+2H2O D.2Fe3++2I-![]() 2Fe2++I2
2Fe2++I2
18、下列制备方法和现象都正确的是( )
A.取新制FeSO4溶液注入试管,再向试管中滴加NaOH溶液,立即有白色沉淀生成
B.往苯酚溶液中滴加几滴浓溴水时,有白色沉淀析出
C.向盛有0.01 mol·L-1 KI溶液的试管中滴加相同浓度的AgNO3溶液,边滴边振荡,可得到浅黄色的AgI胶体
D.淀粉与稀H2SO4共煮后,加入新制Cu(OH)2再加热,有红色沉淀生成
19、能够证明一种胶粒是带正电荷还是带负电荷的实验是()
A.丁达尔现象实验 B.电泳实验
C.渗析实验 D.加热使胶体聚沉实验
20、以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止倒吸的是( )
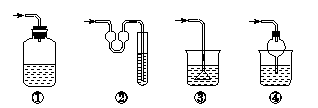
A.②④ B.①② C.①③ D.③④
班级 姓名 分数
Ⅱ卷(40分)
二、填空题
21、(10分)纯碱中常含有少量的NaCl等杂质,下图仪器装置可用来测定纯碱中Na2CO3的质量分数。
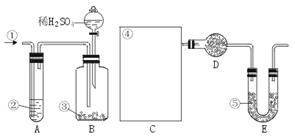
图中:①空气②某溶液③纯碱④某溶液⑤碱石灰(注:碱石灰既能吸收CO2,又能吸
H2O。其实验步骤是:a.按上图所示,组装好实验仪器,并检查其气密性。b.准确称量盛有碱石灰的干燥管D的质量(设为m1 g)。c.准确称量一定量的纯碱(设为n g),并将其放入广口瓶内。d.从分液漏斗中缓慢滴入一定量的稀硫酸,并从“1”处缓慢鼓入空气,直到B容器中不再产生气体为止。e.准确称量干燥管D的总质量(设为m2 g)。
根据上述实验回答下列问题:
(1)该实验进行到操作d时,要缓缓鼓入空气,其作用是____________________ 。装
置A中盛装的液体“2”应选用________________,装置A的作用是________________,
如果撤去装置A,直接向B中缓缓鼓入空气,则会导致实验测定结果(填“偏大”“偏
小”或“不变”)________________。
(2)在空白格内画出装置C及试剂④是__________ ;装置C的作用是
________________;如果撤去装置C,则会导致测定结果________________(填“偏大”“偏 小”或“不变”)
(3)根据此实验,计算纯碱中Na2CO3的质量分数的数学式为________________
(用m1、m2、n表示)
(4)装置E的作用是________________________。
22、(8分)已知:H+(aq)+OH-(aq)![]() H2O(l);ΔH=-57.3 kJ·mol-1,计算下列中和反应中放出的热量。
H2O(l);ΔH=-57.3 kJ·mol-1,计算下列中和反应中放出的热量。
(1)用20 g NaOH配成稀溶液跟足量的稀盐酸反应,能放出 kJ的热量。
(2)用0.1 mol Ba(OH)2配成稀溶液跟足量的稀硝酸反应,能放出 kJ的热量。
(3)用1.00 L 1.00 mol·L-1醋酸溶液与2.00 L 1.00 mol·L-1 NaOH溶液反应,放出的
热量(填大于、小于或等于) 57.3 kJ理由是:
。
23、(12分)某一反应体系有反应物和生成物共五种物质:O2 .H2CrO4. Cr(OH)3. H2O H2O2已知该反应中H2O2只发生反应过程: H2O2→O2
(1)、该反应的还原剂是
(2)、该反应的氧化过程是 →
(3)、写出反应的化学方程式并标明电子转移的方向和数目
(4)、如果反应转移了0.3摩电子,则产生的气体在标况下的体积是 升。
三、计算题
24、(10分)1 g H2S气体完全燃烧,生成液态水和二氧化硫气体,放出17.24 kJ热量,
计算H2S的燃烧热,并写出该反应的热化学方程式。
答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | D | C | D | A | A | B | B | A | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | A | D | A | B | C | C | C | B | A |
21、(1)使纯碱和H2SO4反应产生的CO2全部排出 NaOH溶液 吸收空气中的CO2 偏大
(2)洗气瓶(图略)浓H2SO4吸水 偏大 (3)![]() %
%
(4)防止空气中的水汽和CO2进入D被吸收
22、(1)28.65KJ (2)11.46KJ (3)小于, 因为醋酸电离是吸热的
23、(1)H2O2 (2) H2CrO4→Cr(OH)3 (3) 略 (4)3.36
24、解析1 g H2S完全燃烧,放出17.24 kJ的热量,则H2S的燃烧热为:17.24 kJ·g-1×34 g·mol-1=586.16 kJ·mol-1。
答案586.16 kJ·mol-1 2.H2S(g)+3O2(g)![]() 2SO2(g)+
2H2O(l) ; ΔH=-586.16 kJ·mol-1
2SO2(g)+
2H2O(l) ; ΔH=-586.16 kJ·mol-1
双向细目表
| 题 号 | 知 识 点 | 难度系数 |
| 1 | 硫酸的性质 | 0.60 |
| 2 | 氧化还原反应的判断 | 0.65 |
| 3 | 氧化还原反应的计算 | 0.55 |
| 4 | 离子方程式的判断 | 0.60 |
| 5 | 物质检验 | 0.55 |
| 6 | 原电池计算 | 0.55 |
| 7 | 离子共存 | 0.55 |
| 8 | 钠的性质 | 0.65 |
| 9 | 电解原理 | 0.65 |
| 10 | 原电池的串联 | 0.50 |
| 11 | 燃烧热 | 0.55 |
| 12 | 热化学方程式的判断 | 0.60 |
| 13 | 反应热的概念 | 0.60 |
| 14 | 碱金属 | 0.55 |
| 15 | 热化学方程式的应用 | 0.60 |
| 16 | 硫酸工业 | 0.60 |
| 17 | 氧化还原反应的应用 | 0.55 |
| 18 | 物质的制备 | 0.55 |
| 19 | 胶体 | 0.60 |
| 20 | 气体制备 | 0.65 |
| 21 | 提纯 | 0.50 |
| 22 | 反应热的计算 | 0.60 |
| 23 | 氧化还原反应的综合应用 | 0.60 |
| 24 | 反应热和热化学方程式 | 0.65 |