石家庄市二中2006~2007学年第一学期开学摸底试题
高三化学
可能用到的原子量:H:1 C:12 O:16 Na:23 Al:27 S:32 Cl:35.5
注意:请将答案填写到答案页上,考试结束后只收右侧答案页。
第I卷(选择题 共52分)
一.选择题(本题包括13小题,每小题4分,共52分。每小题只有1个选项符合题意)
1.下列反应的离子方程式正确的是
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu===Fe2++Cu2+
2.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3+N2+3C![]() 2AlN+3CO,下列叙述正确的是
2AlN+3CO,下列叙述正确的是
A. 在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中每生成2 mol AlN,N2得到3 mol电子
C. 氮化铝中氮元素的化合价为-3价
D. 氮化铝晶体属于分子晶体
3.下列反应产物中,有的有同分异构体,有的没有同分异构体。其中一定不存在同分异构体的反应是
A. 异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B. 2—氯丁烷(![]() )与NaOH乙醇溶液共热发生消去HCl分子的反应
)与NaOH乙醇溶液共热发生消去HCl分子的反应
C. 甲苯在一定条件下发生硝化生成一硝基甲苯的反应
D. 邻羟基苯甲酸与NaHCO3溶液反应
4.下列叙述不正确的是
A. 硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解
B. 乙醇的沸点比甲醚(CH3OCH3)高,主要原因是乙醇分子间能形成氢键
C. 反应AgCl+NaBr=AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D. 常温下浓硫酸可贮存于铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
5.下列除去杂质的实验方法正确的是
A. 除去CO中少量O2:通过灼热的Cu网后收集气体
B. 除去K2CO3固体中少量NaHCO3:置于坩埚中加热
C. 除去苯中溶有的少量苯酚:加入稍过量浓溴水反应过滤
D. 除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置
6.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是
A. 3Cl2+6FeI2=2FeCl3+4FeI3 B. Cl2+FeI2=FeCl2+I2
C. Co2O3+6HCl=2CoCl2+Cl2↑+3H2O D. 2Fe3++2I- =2Fe2++I2
7.下列叙述正确的是:
A. 直径介于 1nm ~ 10nm 之间的微粒称为胶体
B. 电泳现象可证明胶体属于电解质溶液
C. 利用丁达尔效应可以区别溶液与胶体
D. 胶体粒子很小,可以透过半透膜
8.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是
A. 常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023
B. 室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023
C. 标准状况下,22.4 L甲苯所含的分子数约为6.02×1023
D. 室温下,a L甲烷和乙烷混合气体中的分子数约为![]() ×6.02×1023
×6.02×1023
9.2002年瑞典科学家发现,某些高温油炸食品中含有一定量的CH2=CH-CO-NH2(丙烯酰胺)。食品中过量的丙烯酰胺可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述:① 能使酸性KMnO4溶液褪色 ② 能发生加聚反应生成高分子化合物 ③ 只有4种同分异构体 ④ 能与氢气发生加成反应。其中正确的是
A. ①②③ B. ②③④ C. ①③④ D. ①②④
10.A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3∶4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是
A. X、Y、Z的稳定性逐渐减弱
B. A、B、C、D只能形成5种单质
C. X、Y、Z三种化合物的熔、沸点逐渐升高
D. 不存在由A、B、C、D四种元素组成的化合物
11.某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的是离子组是
A. K+、Na+、![]() 、
、![]() B. Na+、
B. Na+、![]() 、Cl-、ClO-
、Cl-、ClO-
C. H+、Mg2+、![]() 、
、![]() D. Ag+、K+、
D. Ag+、K+、![]() 、Na+
、Na+
12.关于小苏打水溶液的表述正确的是
A. c(Na+)=c(![]() )+2c(
)+2c(![]() )+c(H2CO3)
)+c(H2CO3)
B. c(Na+)+c(H+)=c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
C. ![]() 的电离程度大于
的电离程度大于![]() 的水解程度
的水解程度
D. 存在的电离有:NaHCO3=Na++![]() ,
,![]()
![]()
![]() +H+。H2O
+H+。H2O![]() H++OH-
H++OH-
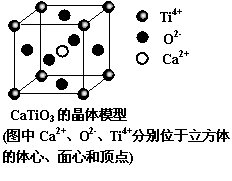 13.下列关于晶体的说法一定正确的是
13.下列关于晶体的说法一定正确的是
A.分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C. SiO2晶体中每个硅原子与两个氧原子以共
价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
第II卷(非选择题 共48分)
二、(本题包括4小题,共48分)
14.(10分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能 / kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
 请回答下列问题:
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC Si;SiCl4_________SiO2
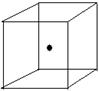
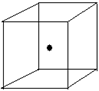
(2)右图立方体中心的“●”表示硅晶体中的一个原子,请在
立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热△H=_____________kJ / mol
15.(15分)以下一些氧化物和单质之间可以发生如下图所示的反应:

其中,氧化物(I)是红棕色固体,氧化物(II)、(III)、(IV)在反应条件下都是气体。
(1)氧化物(I)的化学式(分子式)是 。
氧化物(II)的化学式(分子式)是 。
(2)反应①的化学方程式是 。
反应②的化学方程式是
反应③的化学方程式是
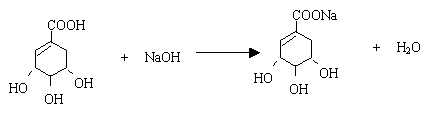
16.(9分)莽草酸是合成治疗禽流感的药物——达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如下:
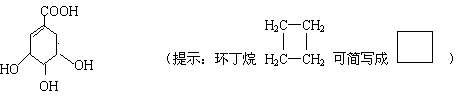
(1)A的分子式是 。
(2)A与氢氧化钠溶液反应的化学方程式(有机物用结构简式表示)是 。
(3)A在浓硫酸作用下加热可得到B(B的结构简式为![]() ),其反应类型
。
),其反应类型
。
17.(14分)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
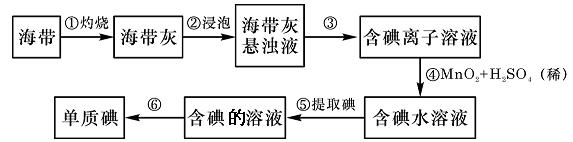
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,可以选择用 来提取碘。
石家庄市二中2006~2007学年第一学期开学摸底试题答案页
姓名 班级 总分
一.选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 |
二.非选择题
 14.(10分)
14.(10分)
(1) ; 。 (2)
(3) 。
15.(15分)
⑴ ; 。
⑵ ① 。
② 。
③ 。
16.(9分)
(1) 。
(2) 。
(3) 。
17.(14分)
(1) 。
(2) ; 。
(3) 。
(4) 。
石家庄市二中2006~2007学年第一学期开学摸底试题
高三化学答案
1.B 2.C 3.D 4.D 5.D 6.A 7.C 8.B 9.D 10.C 11.B 12.D 13.B
14.(10分)
(1)> (2分); < (2分)
(2)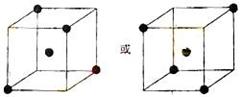 (3分)
(3分)
(3)+236 (3分)
15.(15分)(每空3分)
⑴ Fe2O3 CO
⑵ ① Fe2O3
+ 3 CO ![]() 2 Fe + 3 CO2 ② CO + H2O
2 Fe + 3 CO2 ② CO + H2O ![]() CO2 + H2
CO2 + H2
③ C + H2O ![]() CO + H2 (如写可逆号,同样给分)
CO + H2 (如写可逆号,同样给分)
16.(9分)
(1)C7H10O5 (3分)
(2)
 (3分)
(3分)
(3)消去反应 (3分)
17.(14分)
(1)BDE (3分) (2)过滤 (3分) 蒸馏 (3分)
(3)2I-+MnO2+4H+=Mn2++I2+2H2O (3分)
(4)苯 (2分)