高淳县2005年高三一模化学试卷(附答案)
考试说明:1、本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共150分,考试时间120分钟。
2、请将答案答到答题纸上指定位置,否则不计分。
3、可能用到的数据:
原子量: H 1 C 12 N 14 O 16 Na 23 Si 28 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Cu 64 I 127 Hg 201
第Ⅰ卷(选择题 共72分)
一、选择题(本题包括8小题,每小题4分,共32分;每小题只有一个选项符合题意)
1.1999年1月,俄罗斯科学家合成出第114号元素的原子,该原子的质量数为289,存在时间30S,这项成果具有重要意义。关于此元素或原子的下列说法错误的是
A.中子数与电子数之差为61 B.是第七周期元素
C.是放射性元素 D.是非金属元素
2.能够用键能的大小作为主要依据来解释的是
A.常温常压下氯单质与溴单质的状态不同
B.氯化钠的熔点比碘化钠高
C.稀有气体一般难于发生化学反应
D.钠的密度比钾大
3.工业生产上排放下列气体不会造成大气污染的是
A.NO B.CO C.N2 D.SO2
4.2002年十大科技新闻之一是在世界各地9个研究所39名科学家通力合作下,欧洲核子研究中心成功地制造出约5万个低能量状态的反氢原子。已知反物质的主要特征是电子带正电荷,质子带负电荷。则以下可表示反物质酸与反物质碱进行中和反应实质的离子方程式是
A.H- +OH+====H2O B. H-+OH-====H2O
C.H+ +OH-====H2O D.H++OH+====H2O
5.质量分数为 a%的N a N O3溶液,其物质的量浓度为b mol /L.将此溶液加热蒸发到质量分数为2a%时,其物质的量浓度将
A.等于2b B.大于 2b C.小于2b D.无法判断
6.下列说法不正确的是
A.分子组成为CxH4的烃燃烧前后总体积不变
B.烃分子中连有甲基,则氢原子不可能都在同一个平面上
C.C5H12可能的结构有3种
D.苯既可发生加成反应,也可发生取代反应,还可发生氧化反应
7.配制一定物质的量浓度的NaOH溶液时,造成所配溶液的浓度偏高的是
A.所用NaOH固体已潮解
B.在需用游码的托盘天平上称量NaOH固体时,砝码与固体的位置放颠倒
C.托盘天平的托盘上各放一张纸,调整天平平衡后,将NaOH固体放在左盘的纸上称量
D.定容时,俯视液面达容量瓶的刻度线
8.t ℃时,某NaCl溶液中蒸发掉a g水或加入b g NaCl均恰好成为饱和溶液,则t ℃时NaCl的溶解度是
A.![]() g B.
g B.![]() g C.
g C.![]() g D.无法计算
g D.无法计算
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
9.前一时期“非典型肺炎”在我国部分地区流行,严重危害广大人民的身体健康,做好环境消毒是预防“非典型肺炎”的重要措施,常用的消毒剂是ClO2或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-。下列有关说法中正确的是
A.ClO2的分子结构呈V型,属非极性分子
B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子的数目表示)是Cl2的5倍
C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害
D.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3+2NaClO3+H2SO4====2Na2SO4+2ClO2↑+H2O
10. G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平)
(1) G®Q + NaCl
(2) Q + H2O![]() X + H2
X + H2
(3) Y + NaOH®G+Q+H2O (4) Z+NaOH®Q+X+H2O
这五种化合物中氯的化合价由低到高的顺序是
A.QGZYX B.GYQZX C.GYZQX D. ZXGYQ
11.化合物甲,乙、丙有如下反应转化关系:
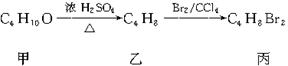
丙的结构简式不可能是
A.CH3CH2CHBrCH2Br B.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3 D.(CH3)2CBrCH2Br
12. 不久前,科学家将6630Zn和20882Pb的原子经核聚合放出一定数目的中子,得到112号新元素,该元素原子的质量数为267。下列说法正确的是
A. 该元素位于第7周期第VIII族
B. 该元素的原子核外共有8个电子层
C. 该元素是“两性”金属元素
D. 66Zn和208Pb两原子聚合成该元素的原子时,同时释放出7个中子
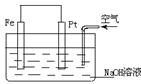 13.对于右图所示装置的叙述正确的是
13.对于右图所示装置的叙述正确的是
A.这是一个原电池的装置
B.这是电解NaOH溶液的装置
C.Pt为正极,其电极反应为:2H++ 2e-====H2↑
D.Fe为负极,其电极反应为:4OH-- 4e-====2H2O + O2↑
14.由两种短周期元素A和M形成的离子化合物A2M3,A3+离子比M2-离子少一个电子层,且A3+具有与Ne原子相同的核外电子层结构,则下列说法正确的是
A.化合物A2M3是三氧化二铝
B.A3+和M2-最外电子层上的电子数都是8
C.A的最高价氧化物对应的水化物是强电解质
D.元素M是第3周期第VI族的元素
15.下列离子方程式书写正确的是
A.向碳酸氢钙溶液中加入足量的氢氧化钠溶液:
Ca2++HCO![]() +OH-====CaCO3↓+H2O
+OH-====CaCO3↓+H2O
B.钠投入硫酸铜溶液中:
Na + Cu2++ 2H2O====Na+ + Cu(OH)2↓+H2↑
C.向碳酸钠溶液中缓慢滴入几滴稀盐酸并不断搅拌:
CO![]() + H+====HCO
+ H+====HCO![]()
D.硫酸镁溶液中加入氢氧化钡溶液:
SO![]() + Ba2+ ==== BaSO4↓
+ Ba2+ ==== BaSO4↓
16.将Na2CO3· 10H2O和 NaHCO3的混合物n g,溶于水制成200 mL溶液,测得
c(Na+)=0.5mol/L。若将n g该混合物加热至质量不再改变时,得到的固体物质的质量为
A.3.l g B.5.3 g C.9.0 g D.11.0 g
17.设NA表示阿伏加德罗常数,下列说法不正确的是
A.a g H2和b g He在同温同压时的体积比为a∶2b
B.2 L 0.1 mol/L的H2S溶液中,含有的H2S分子数小于0.2NA
C.78 g Na2O2与水充分反应,转移的电子数目为NA
D.1 mol FeCl3跟水反应完全转化成氢氧化铁胶体后,生成胶体粒子的数目为NA
18.将胆矾与生石灰、水按质量比为1∶0.56∶100混合配成无机铜杀菌剂波尔多液,其成分的化学式可表示为CuSO4·xCaSO4·xCu(OH)2·yCa(OH)2 ,此种配比当x=3时,则y为
A.1 B.3 C.5 D.7
第Ⅱ卷(非选择题 共78分)
三、(本题包括2小题,共22分)
19.(12分)喷泉是一种常见的自然现象,其产生原因是存在压强差。
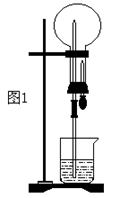
(1)图1为化学教学中所用的喷泉实验装置,在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体,下列组合不可能形成喷泉的是 。
A.HCl和H2O B.O2和H2O C.NH3和H2O D.CO2和NaOH溶液
(2)某学生积极思考产生喷泉的其他办法,并设计了如图2所示的装置。
①在图2的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是 。
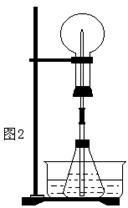 |
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液 C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
 |
②在图2锥形瓶外放一水槽,瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是 。
A.浓硫酸 B.食盐 C.硝酸钾 D.硫酸铜
这种方法产生喷泉的原理是 。
③比较图1和图2两套装置,从产生喷泉的原理来分析,图1是 上部烧瓶内气体压强;图2是 下部锥形瓶内气体压强(均填增大或减小)。
(3)城市常见的喷泉及火山爆发的原理与上述 (填图1或图2)装置的原理相似。
20.(10分)某课外活动小组利用如图所示装置制取氯气。提供的试剂有:浓盐酸、饱和食盐水,氢氧化钠溶液、高锰酸钾固体。反应的化学方程式为:
2KMnO4+ 16HCl(浓)====2KCl+2MnCl2+5Cl2↑+ 8H2O
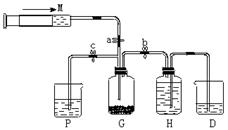
(1)装置H中盛放的试剂是 。
(2)尾气处理时关闭弹簧夹a和弹簧夹 ,打开弹簧夹 。
(3)处理尾气时,发生反应的化学方程式是 。
(4)用含0.032 mol HCl的浓盐酸跟足量高锰酸钾固体反应,产生氯气的物质的量应
(填“大于,等于或小于”)0.01 mol 。
四、(本题包括2小题,共17分)
21.(9分)有X、Y、Z三种元素,已知①它们是周期表中前20号元素,X、Y和Z均不在同一周期;②它们可以组成化合物XY2、YZ2和XZ;③X的阳离子和Z的阴离子的核外电子排布相同;④Y很难形成简单的阳离子或阴离子。请填写下列空白:
(1)X ;Y ;Z 。(填元素符号)。
(2)XY2与水反应的化学方程式是 。
(3)在XY2、YZ2和XZ中,含有非极性键的是 ,含有极性键的非极性分子是 (填化学式)。
22.(8分)537 ℃、1.01×105 Pa时,往容积可变的密闭容器中充入2 mol SO2、l mo1O2,此时容器的体积为200 L 。向容器中加入催化剂(固体)并保持恒温恒压,发生反应:
2SO2(g)
+ O2(g) ![]() 2SO3(g)
2SO3(g)
达到平衡时,平衡气体中SO3的体积分数为0.91 。
试回答下列问题:
(1)工业上二氧化硫的催化氧化采用常压而不采用高压的原因是: 。
(2)保持上述温度和压强不变,若向容器中只充入2 mol SO3 ,并加入固体催化剂。则平衡时,SO2的体积分数是 ,容器的体积为 L 。
(3)温度仍保持537 ℃,容器体积保持200 L不变(恒容)。充入a mol SO2、b mol O2,并加入固体催化剂,反应达到平衡时,SO3的体积分数仍为0.91,体系压强为1.01×105 Pa。
若a∶b=2∶1,则a= 。
五、(本题包括2小题,共21分)
23.(9分)钛(Ti)因为具有神奇的性能越来越引起人们的关注,常温下钛不和非金属、强酸反应。红热时,却可与常见非金属单质反应,钛是航空、军工、电力等方面的必需材料。地壳中含钛的矿石之一称金红石(TiO2),目前大规模生产钛的方法是:
第一步:金红石、炭粉混合在高温条件下通入氯气制TiCl4和一种可燃性气体。该反应的化学方程式为 ,该反应的还原剂是 。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
①写出此反应的化学方程式 。
②如何由上述所得产物中获得金属钛?简述步骤并写出有关反应方程式。
24.(12分)某有机物A在不同条件下反应,分别生成B1+C1和B2+C2;C1又能分别转化为B1或C2;C2能进一步氧化,反应如下图所示:
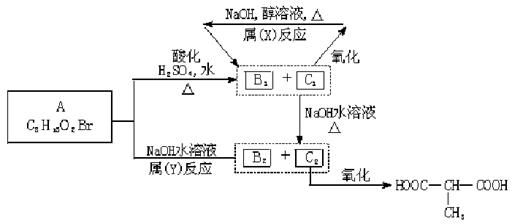 其中只有B1,既能使溴水褪色,又能和Na2CO3溶液反应放出CO2。
其中只有B1,既能使溴水褪色,又能和Na2CO3溶液反应放出CO2。
写出(1)B1、C2分别属于下列哪一类化合物?
①一元醇 ②二元醇 ③酚 ④醛 ⑤饱和羧酸 ⑥不饱和羧酸
B1 ;C2 (填入编号)
(2)反应类型:X 反应;Y 反应;
(3)物质的结构简式:A: ;B2: ;C2: 。
六、(本题包括2小题,共18分)
25.(8分)在20 ℃时食盐的溶解度为36 g,取一定量该温度下的饱和食盐水用惰性电极进行电解,当阳极析出气体5.6 L(标准状况)时,食盐刚好电解完。试计算:
(1)电解时所取饱和食盐水的质量是多少克?
(2)要使溶液恢复到原状态,需要加入 克的 (填物质名称)
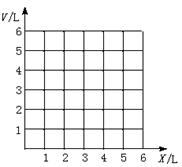
26.(10分)有CO和O2混合气体6 L ,用电火花引燃,经充分反应后体积为V L(所有体积均在同温同压下测定)。
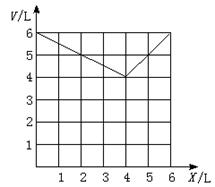
(1)CO在混合气体中的体积为x L,计算X为不同值时反应后的体积V(以X表示)。
(2)在下图上画出V随X变化的曲线。
高淳县2005年高三二模化学试卷 成绩
第Ⅰ卷(选择题,共72分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
第Ⅱ卷(非选择题 共78分)
三、(本题包括2小题,共22分)
19.(12分)(1)不可能形成喷泉的是 。
(2)①可能产生喷泉的是 。
②加入的物质可以是 。原理是 。
③图1是 上部烧瓶内气体压强;图2是 下部锥形瓶内气体压强。
(3)城市常见的喷泉及火山爆发的原理与上述 装置的原理相似。
20.(10分)(1)装置H中盛放的试剂是 。
(2)尾气处理时关闭弹簧夹a和弹簧夹 ,打开弹簧夹 。
(3)处理尾气时,发生反应的化学方程式是 。
(4)产生氯气的物质的量应 (填“大于,等于或小于”)0.01 mol 。
21.(9分)(1)X ;Y ;Z 。(填元素符号)。
(2)XY2与水反应的化学方程式是 。
(3)在XY2、YZ2和XZ中,含有非极性键的是 ,含有极性键的非极性分子是 (填化学式)。
22.(8分)(1)原因是: 。
(2)SO2的体积分数是 ,容器的体积为 L 。
(3)则a= 。
23.(9分)方程式为 ,还原剂是 。
①方程式 。
②步骤:
方程式。
24.(12分)(1)B1 ;C2 (填入编号)
(2)反应类型:X 反应;Y 反应;
(3)A: ;B2: ;C2: 。
25.(8分)(1)解:
(2)需要加入 克的 (填物质名称)
26.(10分)(1)解:
(2)在下图上画出V随X变化的曲线。
高淳县2005年高三二模化学试卷参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| D | B | C | A | B | A | D | C | D | B | B | D | A | BD | C | B | AD | D |
三、19.(1)B(2分)(2)①D(1分)②A(1分)浓硫酸溶于水放热,温度升高,酒精加快挥发,锥形瓶内气体压强增大(2分)③减小(2分) 增大(2分)(3)图2(2分)
20.(1)饱和食盐水(2分) (2)b c(4分)
(3)2NaOH + Cl2====NaCl+ NaClO + H2O(2分) (4)小于(2分)
四、21.(1)Ca C
S(3分)
(2)CaC2+ 2H2O![]() Ca(OH)2+HC≡CH↑(2分)
Ca(OH)2+HC≡CH↑(2分)
(3)CaC2 CS2(4分)
22.(1)常压下,三氧化硫的含量已达到91%,从降低成本考虑,没有必要再加压。(2分) (2)6% 137.5(4分) (3)2.9(2分)
五、23.第一步:TiO2+2C+2Cl2![]() TiCl4+CO
;C(3分)
TiCl4+CO
;C(3分)
第二步:①TiCl4+ 2Mg![]() Ti + 2MgCl2(2分)
Ti + 2MgCl2(2分)
②加入足量的盐酸除去过量金属镁,过滤,并用蒸馏水洗涤固体得金属钛, Mg +2HCl====MgCl2+H2↑(4分)
24.(1)⑥ ②(2分) (2)消去 水解(2分)
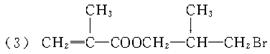 (3)
(3)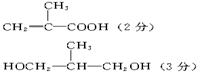
六、25.(1) 110.5 g(3分) (2)18.25 氯化氢(5分)
26.(1)当x=4时,V=4 L(2分)
当X<4 时,V=(6—![]() X)L,(3分)
X)L,(3分)
当X>4 时,V=X L(3分)
(2)(2分)