北京西城区2006年高三第二次模拟考试
(理综)化学试卷 2006.5
可能用到的相对原子质量:H—1、O—16、Na—23、S—32、Cl—35.5
|
|
|
|
|
类使用1000年,而地球上2He含量很少。2He和2He互为
A.同分异构体 B.同系物 C.同素异形体 D.同位素
6.下列操作不是从安全角度考虑的是
A.做氢气还原氧化铜实验时先通氢气排净装置中空气再加热
B.稀释浓硫酸时将浓硫酸沿烧杯壁慢慢注入水中并不断搅拌
C.给试管中的液体加热时,试管口不能对着自己或他人
D.用废铁屑制硫酸亚铁时,先将废铁屑放在碱液中加热1~2 min
7.下列各组中的物质仅用蒸馏水不能鉴别开的是
A.食盐固体、烧碱固体、硝酸铵固体 B.氧化铜、二氧化锰、活性炭
C.蔗糖、硫酸铜粉末、碳酸钙粉末 D.苯、酒精、四氯化碳
8.下列事实能用同一原理解释的是
A.SO2和Cl2都能用于漂白 B.苯酚、乙烯都能跟溴水反应
C.苏打、小苏打水溶液的pH都大于7 D.I2、NH4Cl晶体受热都逐渐消失
9.NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温、常压下,3.5 g 35Cl2所含中子数为0.1NA
B.标准状况下,2.24 LO3气体中含有0.3 NA个原子
C.0.1 mol乙醇中含有0.6 NA个C—H共价键
D.1 molH2O2完全分解时转移电子2NA个
10.已知:Cu+2Fe3+=2Fe2++Cu2+。将Cu片放入0.1 mol/L的FeCl3溶液中,一段时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则n(Cu2+):n(Fe3+)为
A.3:4 B.3:5 C.4:3 D.3:2
11.甲、乙都是短周期元素,其中甲元素原子的最外层电子数是次外层电子数的2倍,乙元素原子K层和M层电子数之和与L层的电子数相同。下列判断不正确的是
A.乙元素的族序数比甲元素的族序数大
B.乙元素最高价含氧酸酸性比甲元素最高价含氧酸酸性强
C.乙元素的原子序数比甲元素的原子序数大
D.含乙元素的化合物数目比含甲元素的化合物数目多
12.将质量分数为a % 的稀硫酸蒸发掉一定量水,使其质量分数为2a %,如果用c1和c2分别表示溶液蒸发前和蒸发后的物质的量浓度,则c1与c2的关系是
A.c1=2c2 B.c2=2c1 C.c2>2c1 D.c2<2c1
25.(16分)有机物A(C7H11Cl3O2)在NaOH水溶液中加热,生成有机物B和C。
(1)产物B(C4H10O3)分子中含有甲基,官能团分别连在不同碳原子上,它与甘油互
为同系物。
① B分子中的官能团名称是___________________。
② B可能的结构简式为__________________、____________________。
③ B不可能发生的反应有________________。
a.消去反应 b.加成反应 c.水解反应
d.氧化反应
(2)C~F有下图所示的转化关系。C、D、E、F分子中均不含甲基,其中E能跟B发
生酯化反应。
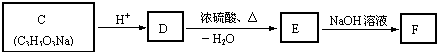 |
① D的结构简式为_______________________________。
② F在一定条件下可转化为PAAS(高分子化合物,常用作食品增稠剂),该反
应的化学方程式为________________________________________________。
(3)如何通过实验证明A分子中含有氯元素,简述实验操作。 ____________________________________________________________________
___________________________________________________________________。
26.(16分)A、B、D、E是周期表中前20号元素,它们的原子序数依次增大。EA2与水反应产生可燃性气体和白色浆状物,向该浆状物中通入AB2气体可得另一白色不溶物。B、D同主族,D的阴离子与E的阳离子具有相同的核外电子排布。请回答:
(1)写出元素符号:A 、B 。
(2)已知AD2与AB2的结构相似,AD2的结构式为 ,该分子是 (填“极性分子”或“非极性分子”)。
(3)镁条在AB2中燃烧的化学方程式为______________________________________。
(4)将D单质放入浓HNO3中加热,生成红棕色气体和一种强酸,该反应的离子方程式为 。
(5)A可形成二元弱酸H2A2O4。0.1 molH2A2O4与100 mL 2 mol/L的KOH溶液反应后,溶液中的离子浓度由大到小的排列顺序是 。
27.(15分)利用下图所示装置制取氧气并进行相关的实验探究。
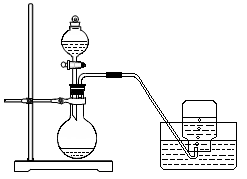
(1)将3.9 g过氧化钠放入烧瓶中,加入100 mLH2O,用排水法收集气体。
① 过氧化钠跟水反应的化学方程式为________________________________。
② 集气瓶充满气体后,怎样从水槽中取出集气瓶?简述操作方法。
______________________________________________________________
______________________________________________________________。
(2)已知:酚酞在c(OH-)在1.0×10-4 mol/L~2.5 mol/L时呈红色,且0.5 min内不会褪色;H2O2具有氧化性和漂白性。取上述实验得到的溶液于试管中,滴入2滴酚酞试液,溶液变红,片刻红色褪去。
① 有人认为,“红色迅速褪去”是由于溶液中c(OH—)过大造成的,试通过估算并
对比数据加以说明。
________________________________________________________________
_______________________________________________________________。
② 还有人认为,“红色迅速褪去”是因为溶液中存在H2O2。试设计实验证明烧瓶
内的溶液中可能有H2O2存在,请简述实验操作。
__________________________________________________________________
_________________________________________________________________。
③ 补充实验,证明“红色迅速褪去”与溶液中存在H2O2有关。请简述实验操作。
__________________________________________________________________
_________________________________________________________________。
28.(13分)硫酸工业生产应考虑综合经济效益。
(1)若从下列四个地区选址新建一座硫酸厂,最合适的地点应在_________附近。
a.风景旅游区 b.硫酸消耗中心区 c.人口稠密区 d.黄铁矿矿区
(2)工业生产硫酸的原料气成分(体积分数)为:SO2 7%,O2 11%,N2 82%。
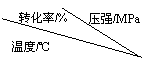 压强及温度对SO2转化率的影响如下:
压强及温度对SO2转化率的影响如下:
| 0.1 | 0.5 | 1 | 10 | |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
工业上,二氧化硫催化氧化过程采用的是常压而不是高压,主要原因是
____________________________________________________________________。
分析上表数据可知,二氧化硫的催化氧化是放热反应,理由是____________________________________________________________________。
(3)据测算,接触法制硫酸过程中,每生产1 t 98%的硫酸需消耗3.60×105 kJ能量。
![]() 若反应:2SO2(g)+O2(g) 2SO3(g),ΔH=-196.6 kJ /mol放出的热量完全被利
若反应:2SO2(g)+O2(g) 2SO3(g),ΔH=-196.6 kJ /mol放出的热量完全被利
用,则每生产1 t 98%的硫酸可为外界提供_____________kJ能量(不考虑其他过
程释放的能量)。
(4)依据题给数据计算:在500℃0.1MPa条件下,二氧化硫的催化氧化达到平衡时,各种气体的体积比V(SO2)∶V(SO3)∶V(O2)∶V(N2)= ∶ ∶ ∶82
(结果保留两位有效数字)。
参考答案
5.D
6.D 7.B
8.C 9.B 10.A
11.D 12.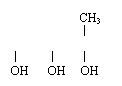
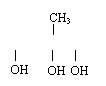 C
C
25.(16分)
(1)① 羟基(2分) ② CH2—C—CH2 (2分) CH2—CH—CH (2分)
③ b(1分) c(1分)
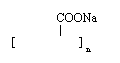 (2)① CH2(OH)CH2COOH
(2分)
(2)① CH2(OH)CH2COOH
(2分)
|
![]() ② nCH2=CHCOONa
—CH2—CH— (3分)
② nCH2=CHCOONa
—CH2—CH— (3分)
(3)取A跟NaOH反应后的水层溶液,加入过量稀HNO3,滴加AgNO3溶液有白色
沉淀生成,说明A中含有氯元素(3分)。其他正确结果参照本标准给分
26.(16分)
(1)C(2分) O(2分)
|
|
|
|
|
|
[c (HC2O4— )与c (H+ )顺序颠倒不扣分]
27.(15分)其他正确结果参照本标准给分
(1)① 2Na2O2+2H2O
= 4NaOH+O2↑(3分)
②
用玻璃片在水面下盖住集气瓶口,将玻璃片与集气瓶一起移出水面,将盖有
玻璃片的集气瓶正放在桌上(3分)。
(2)① 经估算,烧瓶中c(OH—)约为1 mol/L;因为c(OH-)在1.0×10-4 mol/L~2.5
mol/L时酚酞呈红色,因此红色迅速褪去不是由于溶液中c(OH—)过大造成的
(3分)。
② 取烧瓶中的溶液于试管中,加入少量二氧化锰,有气泡放出,用带火星的木
条检验,木条着火,说明溶液中可能有H2O2存在。(3分)
③ 取②中试管里的溶液滴加酚酞试液,溶液变红且不褪色,说明“红色迅速褪
去”与H2O2的存在有关(3分)
28.(13分)其他正确结果参照本标准给分
(1)b(2分)
(2)常压时SO2的转化率已经很大,增大压强会增加动力成本和设备成本(2分);
压强一定时,温度升高SO2转化率下降(3分)
(3)6.23×105 kJ(3分)
(4)V(SO2)∶V(SO3)∶V(O2)∶V(N2)= ( 0.46 )∶( 6.5)∶ (7.7 )∶82(3分)