梅州市2006年第二次质检考试
化学试题
本试卷分第一卷(选择题)和第二卷(非选择题)两部分。第一卷1页至3页,第二卷4页至6页。考试结束后,将本试卷和答题卡一并交回。考试时间120分钟。
注意事项:
1.作答第一卷前,请考生务必将自己的姓名、考试证号用书写黑色字迹的签字笔填写在答题卡上,并认真核对监考员所粘贴的条形码上的姓名、考试证号是否正确。
2.第一卷答案必须用2B铅笔填涂在答题卡上,在其他位置作答一律无效。每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案。
可能用到的相对原子质量:H 1 N 14 O 16 Na 23 Al 27
第一卷(选择题 共67分)
一、选择题(本题包括9小题。每小题3分,共27分。每小题只有一个选项符合题意)
1.纳米材料是当今世界的一种新型材料,广泛地应用于建筑、医学、电子等方面,纳米材料是指( )
A.尺度为米粒大小的颗粒制成的材料 B.尺度为![]() m数量级的小颗粒制成的材料
m数量级的小颗粒制成的材料
C.尺度为![]() m数量级的小颗粒制成的材料 D.尺度为
m数量级的小颗粒制成的材料 D.尺度为![]() m数量级的小颗粒制成的材料
m数量级的小颗粒制成的材料
2.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为
①2MoS2 + 7O2
![]() 2MoO3 + 4SO2;
2MoO3 + 4SO2;
②MoO3 + 2NH3·H2O = (NH4)2MoO4 + H2O;
③ (NH4)2MoO4 + 2HCl = H2MoO4↓+ 2NH4Cl;
④H2MoO4
![]() MoO3 + H2O;
MoO3 + H2O;
⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是
A.MoS2煅烧产生的尾气可直接排空
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2
3.下列叙述肯定正确的是( )
A.构成分子晶体的微粒一定含有共价键 B.较不活泼的金属单质不能还原较活泼的金属阳离子
C.酸和碱之间的反应都是复分解反应 D.熔化时无需破坏化学键的晶体一定是分子晶体
4.神舟六号载人飞船的成功发射和回收,是我国航天史上一座新的里程碑,标志着我国在攀登世界科技高峰的征程上,又迈出了具有重大历史意义的一步。下列叙述正确的是
A.可作为飞船内供氧物质的是KMnO4、Na2O2
B.钛作为一种重要的航天金属,在工业上可用钠还原钛的卤化物来制备
C.飞船助推火箭外层的涂料是一种性质稳定、不易分解的材料
D.航天员所用的“尿不湿”是一种高分子材料制成的,该材料属于纯净物
5.某同学想用实验证明高锰酸钾溶液的紫红色是![]() 离子的颜色而不是
离子的颜色而不是![]() 的颜色,他设计的下列实验步骤中对实验结论没有意义的是( )
的颜色,他设计的下列实验步骤中对实验结论没有意义的是( )
A.将高锰酸钾晶体加热分解,所得固体质量减少
B.观察氯化钾溶液没有颜色,表明溶液中![]() 无色
无色
C.在氯化钾溶液中加入适量锌粉振荡,静置未见变化,表示锌与![]() 无反应
无反应
D.在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明![]() 为紫红色
为紫红色
6.将SO2气体通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则通入的气体可能是
A.CO2 B.NH3 C.NO2 D.H2S
7.NA为阿伏加德罗常数。下列叙述正确的是( )
A.1 L lmol·L-1盐酸中,所含氯化氢分子数为NA。
B.标准状况下11.2L四氯化碳所含分子数为0.5NA
C.2.8 g氮气所含的原子数目为NA
D.25℃时,2 g氢气中含有NA个氢分子
8.向某二价金属M的M(OH)2的溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体。如要计算金属M的相对原子质量,你认为还必需提供下列哪项数据
A.M(OH)2溶液的物质的量浓度 B.与MCO3反应的盐酸的物质的量浓度
C.MCO3的质量 D.题给条件充足,不需要在补充数据
9.法国化学家伊夫·肖万获2005年诺贝尔化学奖。他发现了烯烃里的碳碳双键会被拆散、重组,形成新分子,这种过程被命名为烯烃复分解反应 。烯烃复分解反应可形象地描述为交换舞伴。烯烃复分解反应中的催化剂是金属卡宾(如CH2=M),金属卡宾与烯烃分子相遇后,两对舞伴会暂时组合起来,手拉手跳起四人舞蹈。随后它们“交换舞伴”,组合成两个新分子,其中一个是新的烯烃分子,另一个是金属原子和它的新舞伴。后者会继续寻找下一个烯烃分子,再次“交换舞伴”。把C6H5CH2CH=CH2与CH2=M在一定条件下混合反应,下列产物不可能存在的是( )
A.C6H5CH2CH=M B.CH2= CH2
C.C6H5CH2CH2C6H5 D.C6H5CH2CH=CHCH2C6H5
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分)
10. 下列离于方程式正确的是( )
A.钠与水反应:Na+2H2O=Na++2OH-+H2↑
B.往碳酸氢钙溶液中加过量烧碱:HCO3-+OH-=CO32-+H2O
C.用醋酸中和氢氧化钠溶液:H++OH-=H2O
D.将饱和氯化铁溶液滴人沸水中:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
11. 密闭容器中,反应a M(g)+b N(g)![]() c
P(g)达到平衡时,M的浓度为0.5mol·L-1,若保持温度不变,将容器的容积扩大到原来的2倍,重新达到平衡时,M的浓度为0.3mol·L-1。下列判断合理的是( )
c
P(g)达到平衡时,M的浓度为0.5mol·L-1,若保持温度不变,将容器的容积扩大到原来的2倍,重新达到平衡时,M的浓度为0.3mol·L-1。下列判断合理的是( )
A.a+b>c B.平衡向正反应方向移动
C.N的转化率降低 D.P的体积分数增大
12. YO3n-和S2-在水溶液中发生如下反应:YO3n-+3S2-+6H+==Y一+3S↓+3H2O,YO3n-中Y元素的化合价为( )
A.+4 B.+5 C.+6 D.+7
14. 常温下,分别往pH=l的酸和pH=14的NaOH溶液中加入足量的铝,放出H2的量前者多,原因可能是( )
A. 酸是多元强酸,酸、碱溶液体积相同
B.酸是一元弱酸,酸、碱溶液体积相同
C.酸是强酸,其体积比碱溶液大
D.酸是强酸,其浓度比碱溶液大
15. 能正确表示可燃物燃烧热的热化学方程式是( )
A.H2(g)十C12(g)==2HCl(g);△H= -184.6kJ·mol-1
B.CH4(g)+2O2(g)==2H2O(g)+CO2(g);△H= -802.3 kJ·mol-1
C.2CO(g)+O2(g)==2CO2(g);△H=+566 kJ·mol-1
D.H2(g)+O2(g)==H2O(1);△H=-285.8 kJ·mol-1
16.中学化学课本中有大量的数据材料,下列是某学生对数据的利用情况,其中不科学的是 ( )
A.应用密度数据判断液态物质是否溶于水
B.应用固体溶解度数据判断某些复分解反应能否进行
C.应用原子半径数据比较同主族元素的金属性(或非金属性)强弱
D.应用沸点数据推测能否将某些液体混合物分离
17. a、、b、c、d、e分别为MgCl2、KHSO4、KOH、NaHCO3、A1C13等五种溶液中的一种,其中a能与其余四种溶液反应,且与c、e反应时有明显的现象;b与d反应只产生气泡;e只能与a反应。下列推理不正确的是( )
A. a一定为KOH
B.b一定为KHSO4
C.c一定为A1C13
D .e一定为MgCl2
18. 在碳酸钠稀溶液中,下列关系正确的是( )
A.c(Na+)=2c(CO32-) B.c(OH-)=c(H+)
C.(HCO3-)>c(H2CO3) D.c(Na+)<2c(CO32-)+c(HCO3-)
19. 下列变化过程中,共价键被破坏的是( )
A.油脂硬化 B.氯化氢气体溶于水
C.氯化钠溶于水 D.氯气被活性炭吸附
第Ⅱ卷 (非选择题 共83分)
三、(本题包括2小题,共22分)
20.(14分) I.课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
⑴实验室可用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式
。
⑵某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
。
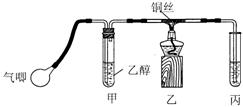 Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白:
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白:
⑴乙醇发生催化氧化的化学反应方程式为
。
⑵实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是 ____;由于装置设计上的缺陷,实验进行时可能会 ____________
⑶反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。
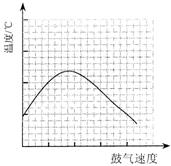
试解释鼓气速度过快,反应体系温度反而下降的原因:
;你认为该实验中“鼓气速度”这一变量可用 来计量_____________________________。
21.(10分)在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是: (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物是
(2)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象。
| ( )同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 | ||
| 第二种方法 |
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是 若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行? 理由是:
四、(本题包括2小题,共21分)
22. (10分)镍(Ni)镉(Cd)电池在通讯、交通及日常生活中有着广泛的应用,其工作原理可用Cd+2NiO(OH)+2H2O ![]() 2Ni(OH)2+Cd(OH)2(以强碱为电解质)表示。已知,
2Ni(OH)2+Cd(OH)2(以强碱为电解质)表示。已知,
NiO(OH)、Ni(OH)2和Cd(OH)2均难溶于水。
(1)下列有关镍镉电池的说法中,正确的是 (填标号)。
A.其充电和放电过程的反应互为可逆反应 B.放电时,化学能转化为电能
C.充电时,电解质溶液的pH不变 D.放电时,镉为负极
(2)充电时,阴极上发生反应的电极反应式是 。
(3)废镍镉电池会污染土壤,在酸性土壤中污染尤为严重,其原因是
。
(4)以镍镉电池为电源电解Na2SO4水溶液,当收集到气体的总体积为33.6L(标准状况)
时,镍镉电池中转移了 mol电子。
23. (11分) 有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。
⑴写出只含有A、B、D、E四种元素的两种无水盐的化学式 、 。
⑵右图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示
,与每个“构成粒子”相邻的粒子呈
空间构型。E与D按原子个数比1﹕1形成的化合物的电子式为
。
⑶人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 | F—D | F—F | B—B | F—B | C═D | D═D |
| 键能/kJ·mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②试估算F单质晶体的燃烧热: 。
五、(本题包括2小题,共18分)
24. (8分)A、B都是芳香族化合物,相对分子质量都不超过200,完全燃烧都只生成CO2和H2O。1 molA与1mol某一元羧酸发生酯化反应生成B,B能在一定条件下发生银镜反应而A不能;A中氧元素的质量分数为31.6%,B的溶液有酸性,但不能和FeCl3溶液发生显色反应。请根据上述信息,完成下列填空:
⑴A的分子式是 ,你确定A分子中氧原子数目的理由是
⑵若1molA只能与1molNaOH发生反应,且A苯环上一取代产物只有两种,则A的结构简式为 。
⑶B的同分异构体甚多。其中不属于酚类且1mol能与3molNaOH反应的同分异构体的结构筒式为
(任写一种)。
25. (10分)药用有机物A为一种无色液体。从A出发可发生如下一系列反应
请回答:
 |
⑴化合物F结构简式: 。
⑵写出反应①的化学方程式: 。
⑶写出反应④的化学方程式: 。
⑷有机物A的同分异体甚多,其中属于羧酸类的化合物,且含有苯环结构的异构体有______ 种
⑸E的一种同分异构体H,已知H可以和金属钠反应放出氢气,且在一定条件下可发生银镜反应。试写出H的结构简式: 。E的另一种同分异构体R在一定条件下也可以发生银镜反应,但不能和金属钠反应放出氢气。试写出R的结构简式: 。
六、(本题包括2小题,共20分)
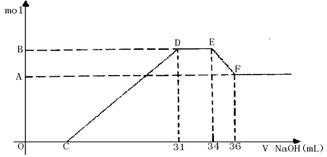
26. (9分)硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合价越低。若硝酸现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4mol /LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。求:
|
(1)B与A的差值: mol;
(2)B的数值: mol;
(3)C的数值: mL。
(要求有计算过程)
27.
(11分)常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题。
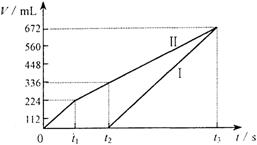 ⑴通过计算推测:
⑴通过计算推测:
①原混合溶液NaCl和CuSO4的物质的量浓度。
②t2时所得溶液的pH。
⑵实验中发现,阳极产生的气体体积与阴极相比,明显小于对应时间段的理论值。试简要分析其可能原因。
化学试题参考答案
第Ⅰ卷 (选择题 共67分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
|
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷 (非选择题 共83分)
三、(本题包括2小题,共24分)
20.Ⅰ.
⑴![]()
![]()
或![]()
![]()
⑵用pH试纸检测溴水与褪色后溶液的酸碱性。若酸性明显增强,则猜想①正确;反之,猜想②正确(或其它合理方法)
![]() Ⅱ.
Ⅱ.
⑴2CH3CH2OH+O2 2CH3CHO+2H2O
⑵使生成乙醇蒸气的速率加快且较均匀 发生倒吸
⑶过量的气体将体系中的热量带走 单位时间内甲中的气泡数(每空2分,共14分)
21.(1)Br2(1分);Fe3+(1分)
(2)
| 乙 (1分) 同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 | C(1分) | 有机层无色(1分) |
| 第二种方法 | D(1分) | 溶液变红(1分) |
(3)Fe2+(1分);不可以,(1分)因为Br2和Fe3+都能把I—氧化成I2(1分)
22.(1)B、D (2分)
(2)Cd(OH)2+2e- ==Cd+2OH- (3分)
(3)在酸性土壤中,Ni(OH)2、Cd(OH)2和NiO(OH)更易转化为Ni2+、Cd2+、Ni3+等重金属离子 (3分)
(4)2 (2分)
23. ⑴NaHCO3 (1分) CH3COONa (1分) (或其它有机酸的盐)
⑵氢键(2分) 正四面体(1分) Na+[![]() ]2-Na+(2分)
]2-Na+(2分)
⑶①acb (2分) ②990.7kJ/mol (2分)
24. ⑴C8H8O3 A中至少一个 -OH和-COOH故氧原子至少为3个;但若氧原子数大于等于4,则M(A)>200
⑵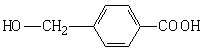 ⑶
⑶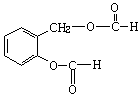
(其它合理答案也给分)(每空2分,共8分)
25.⑴化合物F结构简式:(2分)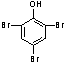
⑵反应①的化学方程式为:![]() +2NaOH
+2NaOH![]() CH3COONa+
CH3COONa+![]() + H2O(2分)
+ H2O(2分)
⑶写出反应④的化学方程式:
CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O(2分)
CH3COOCH2CH3+H2O(2分)
⑷有机物A的同分异体中属于羧酸类的化合物,且含有苯环结构的异构体有4 种它们分别是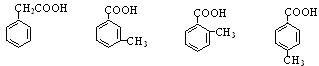 (2分)
(2分)
⑸H的结构简式:![]() ,R的结构简式:HCOOCH3 。(各1分共2分)
,R的结构简式:HCOOCH3 。(各1分共2分)
26. 0.008 0.032 7
27、⑴①阳极首先逸出的是氯气
n(NaCl)=2 n(Cl2)=0.02mol 则c(NaCl)=0.1mol/L(3分)
阳极得到336mL气体中,含0.01mol Cl2和0.005molO2
转移电子的物质的量为:0.01mol×2+0.005mol×4=0.04mol
此过程中阴极刚好全部析出铜
n(CuSO4)=n(Cu)=![]() =0.02mol 则c(CuSO4)=
=0.02mol 则c(CuSO4)=![]() =0.1mol/L(3分)
=0.1mol/L(3分)
②t2时溶液中c(Na+)=0.1mol/L,c(SO42-)=0.1mol/L
根据电荷守恒有:c(H+)=2×0.1mol/L-0.1mol/L=0.1mol/L 即溶液的pH=1(3分)
⑵产生的氯气和氧气在水中的溶解度明显大于氢气(2分)