福州市2005-2006学年第一学期期末质检
高三化学综合练习
(完卷时间:120分钟;满分:100分)
| 题号 | 一 | 二 | 三 | 四 | 五 | 总分 |
| 得分 | ||||||
| 评卷人 |
可能用到的相对原子质量:H-1、C-12、N-14、O-16、Na-23、Mg-24、Al-27、K-39、Cu-64
(Ⅰ卷 共50分)
一、选择题:(下列各题只有一个选项符合题意。每小题2分,共50分)
1.科学家最近制造出第112号新元素,其原子质量数为277。这是迄今为止已知的元素中最重的原子。下列关于该元素的叙述中,正确的是( )
A.该元素原子的核电荷数为165 B.该原子核内中子数与核外电子数之差为53
C.该原子质量是12C原子质量的277倍 D.该元素的相对原子质量为277
2.某校学生用化学知识解决生活中的问题,下列家庭小实验不合理的是( )
A.用食醋除去暖水瓶中的薄层水垢 B.用米汤检验含碘盐中的碘酸钾(KIO3)
C.用食用碱(Na2CO3)溶液洗涤餐具上的油污 D.用灼烧并闻气味的方法区别纯棉织物和纯毛织物
3.生活中的某些问题,常常涉及到化学知识,下列分析正确的是( )
A.氯气和二氧化硫均可作漂白剂,若同时使用它们去漂白某一湿润的有色物质,漂白效果会明显加强
B.为预防碘缺乏病的目标,我国卫生部规定食盐必须加碘,其中碘是以单质的形式存在
C.苯酚有杀菌和止痛作用,药皂中也掺有少量的苯酚,所以我们可以用苯酚对环境消毒或直接涂抹于皮肤上进行消毒
D.工业酒精不能加水当酒品尝,其原因是它含有甲醇,它虽有酒香味,但饮后会导致中毒,甚至死亡
4.有几种试验事故处理方法:① 镁着火使用二氧化碳扑灭。② 不慎将浓硫酸沾到皮肤上,
应迅速用布擦去,再用水冲洗,再涂上稀小苏打溶液。③ 苯酚洒到皮肤上用碳酸氢钠溶液洗。④ 误食铜盐后,喝生牛奶或蛋清。其中正确的是( )
A.① B.④ C.②④ D.②③
5下列制取硫酸铜的实验设计能体现“经济、高效、环保”精神的是( )
A.铜与浓硫酸共热
B.用铜片为阳极,石墨为阴极,电解稀硫酸
C.先灼烧废铜屑生成氧化铜,然后再用浓硫酸溶解
D.适当温度下,使铜片在持续通入空气的稀硫酸中溶解
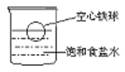 6.将一空心铁球放入盛有密度为 ρ g/cm3的饱和食盐水的烧杯中,铁球所处位
6.将一空心铁球放入盛有密度为 ρ g/cm3的饱和食盐水的烧杯中,铁球所处位
置如右图所示。将下列物质分别加入烧杯中,能使铁球上浮的是( )
A.食盐晶体 B.酒精
C.密度为ρ g/cm3的稀硫酸 D.密度为ρ g/cm3的CuSO4溶液
7.下列变化中证明硫酸是强酸的是( )
A.和铜反应 B.和锌反应放出H2
C.与NaCl反应制HCl D.与Ca3(PO4)2反应制H3PO4
8.Rm+与Xn-具有相同的电子层结构,则微粒半径
A.前者大于后者 B.前者小于后者 C.前者等于后者 D.大小比较不能确定
![]() 9.铅蓄电池反应如下:
9.铅蓄电池反应如下:![]() 对铅蓄电池工作情况,下列叙述错误的是( )
对铅蓄电池工作情况,下列叙述错误的是( )
A.放电时Pb极为负极
B.充电时蓄电池上标有“+”号电极连接电源正极
C.放电时正极反应为PbO2+ SO42— +4H++2e ==PbSO4+2H2O
D.充电时蓄电池上标有“—”号的电极发生氧化反应
10.下列各组离子因发生氧化还原反应而不能大量共存的是( )
A.H+、Fe2+、NO3—、Cl— B.K+、Fe3+、NO3—、SCN—
C.Al3+、Na+、Cl—、AlO2— D.Ca2+、NH4+、SO42—、OH—
11.溶质为11.2g的KOH稀溶液与0.1L 1.0mol•L-1的H2SO4溶液反应可放出11.46kJ的热量。下列能表示中和热的热化学方程式为( )
A.KOH(aq)+1/2 H2SO4(aq)=1/2 K2SO4+H2O(l);ΔH=-11.46 kJ•mol-1
B.2KOH(aq)+ H2SO4(aq)= K2SO4+2H2O(l);ΔH=-114.6 kJ•mol-1
C.2KOH(aq)+ H2SO4(aq)= K2SO4+2H2O(l);ΔH= +114.6 kJ•mol-1
D.KOH(aq)+1/2 H2SO4(aq)=1/2 K2SO4+H2O(l);ΔH=-57.3 kJ•mol-1
12.pH=2的两种一元酸HX和HY分别与足量锌粉反应,所生成的H2体积 V(HX)>V(HY)。下列说法正确的是( )
A.这两种酸的物质的量浓度一定相同而体积不同 B.酸的物质的量浓度 c (HX)一定大于c (HY)
C.若两种酸体积相同,则HY的酸性比HX酸性强 D.HY一定不是弱酸
13.下列实验中,由于错误操作导致所测出的数据一定偏低的是( )
A.用量筒量取一定体积液体时,俯视读出的读数
B.用标准盐酸滴定未知浓度的NaOH溶液,酸式滴定管未用标准盐酸溶液润洗,所测出的碱液的浓度值
C.测定硫酸铜晶体中结晶水含量时,加热温度太高使一部分硫酸铜发生分解,所测出的结晶水的含量
D.做中和热测定实验时,在大小烧杯之间没有垫碎泡沫塑料(或纸条),所测出的中和热的数值
14.在一个固定体积的密闭容器中加入2mol A,发生可逆反应:2A(g) ![]() 2B(g)+C(g)。该反应达到平衡的标志是( )
2B(g)+C(g)。该反应达到平衡的标志是( )
A.容器内压强是开始时的1.5倍 B.容器内A、B、C物质的量浓度之比为2∶2∶1
C.单位时间消耗0.2molA同时生成0.1molC D.容器内各物质的浓度不随时间变化
15.对于密闭容器中进行的反应,CO(g)+H2O(g) ![]() CO2(g)+H2(g),△H<0,改变下列条件,平衡一定正向移动的是( )
CO2(g)+H2(g),△H<0,改变下列条件,平衡一定正向移动的是( )
A.增大压强 B.通入CO2 C.降温 D.加入催化剂
16.下列叙述中指定粒子的数目大于阿伏加德罗常数的是( )
A.2 g重水(D2O,D为2 1H)中含有的中子数 B.0.1 mol F-中含有的电子数
C.常温常压下,11.2 L N2和NO混合气体中的原子数 D.1 L 1mol·L - 1Na2SO4溶液中的Na+离子数
17.对室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
A.加适量的醋酸钠晶体后,两溶液的pH均增大 B.使温度都升高20℃后,两溶液的pH均不变
C.加水稀释2倍后,两溶液的pH均减小 D.加足量的锌充分反应后,两溶液中产生的氢气一样多
18.将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加入少量硫酸铜溶液,下列各图产生H2的体积V(L)与时间t(min)的关系中正确的是( )
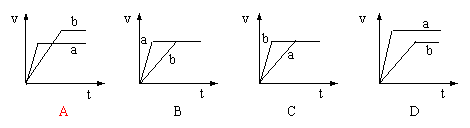 |
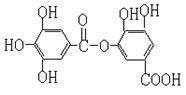
19.右图表示某种有机物的结构,关于它的性质叙述中正确的是( )
A.它能水解生成两种产物 B.不能溶于有机溶剂
C.不能与NaHCO3反应放出气体 D.1mol该有机物在一定条件下,能与8molNaOH反应
20.根据物质的性质和用途,可将碱石灰、P2O5和CaCl2(固)归为一类。从以下选项中选出能与这三种物质归为一类的物质应该是( )
A.浓HNO3 B.NaCl C.NaHCO3 D.浓H2SO4
21.若溶液中由水电离产生的![]() ,满足此条件的溶液中一定可以大量共存的离子组是( )
,满足此条件的溶液中一定可以大量共存的离子组是( )
A.![]() 、
、![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]() 、
、![]()
22.某无色气体,可能含HCl、CO2、NO2、HI、SO2、HBr中的一种或几种。将其通入氯水中,
得到无色透明溶液,把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀,另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是( )
A.一定存在HCl B.一定存在SO2
C.肯定没有CO2 D.不能肯定是否含有NO2、HI
23.1L某混合溶液中,溶质X、Y的浓度都为0.1mol·L-1,向混合溶液中滴加某溶液Z(0.1mol·L-1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X、Y、Z分别是( )
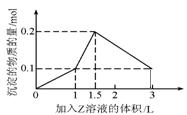 A.氯化铝、氯化铁、氢氧化钠
A.氯化铝、氯化铁、氢氧化钠
B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸
D.偏铝酸钠、氯化钡、硫酸
24.反应 mA(g)+nB(g)![]() pC(g)+qD(s)测得平均反应速率ν(C)=2ν(B),达到平衡后若保持温度不变,给体系加压平衡不移动,则m、n、p、q的数值分别是( )
pC(g)+qD(s)测得平均反应速率ν(C)=2ν(B),达到平衡后若保持温度不变,给体系加压平衡不移动,则m、n、p、q的数值分别是( )
A.5、3、6、2 B.1、1、2、2 C.3、1、2、1 D.1、2、1、2
25.质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg
水。得到的溶液每毫升质量为qg,物质的量浓度为c,则溶质的分子量(相对分子质量)
为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(Ⅱ卷 50分)
二.填空题(共21分)
26.(6分)经测定H2O2为二元极弱酸,其酸性比碳酸弱且有漂白性。它在碱性溶液中极不稳定,易分解生成H2O和O2。若向Na2O2中通入干燥的CO2的气体,Na2O2与CO2并不反应,它与潮湿的CO2反应放出气体后的液体仍可使品红试液颜色有所减退。
(1)写出H2O2在其水溶液中的电离方程式: 。
(2)用化学方程式表示Na2O2和潮湿的CO2气体反应的过程:
①: 、②: 。
27.(15分)已知X和Y均为短周期元素,原子序数X>Y。在一定条件下,X和Y单质可直接化合生成化合物Z,Z在常温下和水可迅速反应生成气体P和化合物Q。
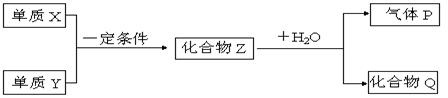 |
(1)若气体P就是单质Y,则X单质是 ,Y单质是 ,化合物Q的电子式为 。
(2)若气体P有臭鸡蛋气味,化合物Q是可溶于强碱溶液的白色沉淀,则X单质是 ,Y单质是 ,化合物Q溶于强碱溶液的离子方程式为 。
(3)若气体P能使湿润的红色石蕊试纸变篮,化合物Q是可溶于强酸的白色沉淀,则X单质是 ,Y单质是 ,化合物Z和水反应的化学方程式为_ 。
三、有机填空题(12分)
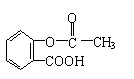
28.(12分)有机物A可发生如下转化:
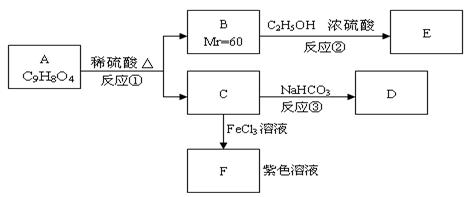
(1)化合物A是一种邻位二取代苯,其中一个取代基是羧基,则A的结构简式是___________。
(2)反应①、②都可属于取代反应。其中①是_________反应,②是 反应。(填有机反应名称)
(3)反应③的化学方程式是_______ ____。
(4)A与NaOH溶液共热,可发生反应生成B与C的钠盐。与1molA反应,所消耗的NaOH物质的量为___________。
(5)与A具有相同官能团(—COOH和—COO—)的A的同分异构体很多,请写出其中三种邻位二取代苯的结构简式____ ______,___ _______,________ ___。
四、实验题(7分)
29(7分)右图所示装置是化学实验中常见的仪器,它除用于洗气外,还有其他用途:
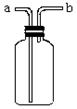 (1)医院里给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装盛有水的该装置,
(1)医院里给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装盛有水的该装置,
用于观察气泡产生的情况,以便调节供氧速率,此时氧气应从 (填标号,下同)
管口导入。
(2)实验室用MnO2与浓HCl反应制Cl2的实验中,在将生成的Cl2通入NaOH溶液之前,
先将Cl2从该装置 管口导进,从 管口导出。此时,该装置所起的作用是
防止NaOH溶液倒流入反应器。
(3)当用此装置收集NO时,应采取的主要操作步骤是:
① ;
② 。
五、计算题(10分)
30.(10分)有总物质的量一定的甲烷和某有机物A(分子式为CaHbOc,a≥1、c≥1、b为正整数)的混合物。
(1)若混合物中甲烷和A不论以何种比例混合,其完全燃烧所生成的水的物质的量不变,则A的组成必须满足的条件是 ;符合此条件的A中,相对分子质量最小的A的分子式为 。
(2)若混合物中甲烷和A不论以何种比例混合,其完全燃烧所消耗的氧气和生成的水的物质的量均不变,则A的组成必须满足的条件是 ;符合此条件的A中,相对分子质量最小的A的分子式为 。
(3)若有机物CxHy(x、y为正整数)和CaHbOc(a≥x)不论以何种比例混合,只要混合物的总物质的量一定,完全燃烧时所消耗的氧气和生成的水的物质的量均不变,那么,这两种有机物的组成必须满足的条件是(用含x、y、a、b、c等的代数式表示): 。
【参考答案】
一、选择题:(下列各题只有一个选项符合题意。每小题2分,共50分)
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | B | B | D | C | D | C | D | B | D | A | D | C |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| D | D | C | D | A | A | C | D | B | B | C | B | C |
二.填空题(共21分)
26.(6分)(1)H2O2![]() H++HO2–
H++HO2–
![]() (2)Na2O2+CO2+H2O Na2CO3+H2O2
(2)Na2O2+CO2+H2O Na2CO3+H2O2
|
![]() 2H2O2 2H2O+O2
2H2O2 2H2O+O2
27.(15分)
(1)Na;O2;(各1分,共2分) ![]() (3分)
(3分)
(2)S;Al;(各1分,共2分) Al(OH)3+OH-=AlO2-+2H2O (3分)
(3)Mg;N2;(各1分,共2分) Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ (3分)
三、有机填空题(12分)
 28.(12分)
28.(12分)
(1) (2分)
(2)酯的水解 ;羧酸和醇的酯化 (各1分,共2分)
 |
(3) (3分)
(4)3mol (2分)
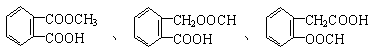 |
(5)
(各1分,共3分)
四、实验题(7分)
29(7分).(1)a(1分)
(2)b a(2分)
(3)①集气瓶中先充满水,②将NO从b管口导入(4分)
五、计算题(10分)
30.(每空2分,共10分)
(1)b=4(或A分子式中氢原子数为4);CH4O
(2)A和CH4分子式相差n个CO2,n为正整数; C2H4O2
(3)y=b 和2(a-x) = c