高三化学同步检测(十二)
第五单元单元测试(B卷)
说明:本试卷分为第Ⅰ、Ⅱ卷两部分,请将第Ⅰ卷选择题的答案填入题后括号内,第Ⅱ卷可在各题后直接作答。共100分,考试时间90分钟。
第Ⅰ卷(选择题共48分)
一、选择题(每小题只有一个正确答案,每小题3分,共48分)
1近年来,国际上提出的“绿色化学”是指化学工业生产中的()
A.对废水、废气、废渣进行严格处理
B.不排放任何有害物质
C.在化工厂周围种草、种花、种树,使化工厂成为花园式工厂
D.以绿色植物为原料,以生物催化剂实现化工生产过程的化学
解析“绿色化学”指在化工生产中不排放有害物质。
答案B
2某雨水样品刚采集时测得pH为4.82,放在烧杯中2小时后,再次测得pH为4.68,以下叙述正确的是 …()
A.雨水样品酸度逐渐减小
B.雨水样品酸度没有变化
C.雨水样品继续吸收空气中的CO2
D.雨水样品中的H2SO3被氧化成H2SO4
解析酸雨的成因是NOx和SO2,前者形成HNO3,后者形成H2SO3,被空气中氧气氧化后生成H2SO4,pH减小。
答案D
3下列反应能用勒夏特列原理解释的是()
A.由SO2和O2反应制SO3需使用催化剂
B.燃烧粉碎的黄铁矿矿石有利于SO2的生成
C.硫酸生产中用98.3%的硫酸吸收SO3,而不用H2O或稀硫酸吸收SO3
D.用N2和H2合成氨需采用高压
解析A选项和B选项主要是考虑反应速率问题;C选项不用水或稀硫酸吸收SO3,原因是SO3与水反应放热,易形成硫酸酸雾。
答案D
4反应SO2(g)+NO2(g)![]() NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是()
NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是()
①平衡左移,容器内压强不一定增大 ②平衡右移,平衡时容器内压强不一定增大 ③平衡不一定移动,容器内压强一定增大 ④平衡右移,SO2转化率提高
A.①② B.②③ C.③④ D.②④
解析该反应是一个气体的等体积反应。加入一定量的O2,2NO+O2![]() 2NO2,导致c(NO)减小,c(NO2)增大,故平衡右移,SO2的转化率提高。当加入的O2和NO反应时,O2不足量,容器压强不变;O2过量,容器压强增大时。故②④正确,选D。
2NO2,导致c(NO)减小,c(NO2)增大,故平衡右移,SO2的转化率提高。当加入的O2和NO反应时,O2不足量,容器压强不变;O2过量,容器压强增大时。故②④正确,选D。
答案D
5(2005年上海)浓硫酸和2 mol·L-1的稀硫酸,在实验室中敞口放置。它们的质量和放置天数的关系如下图。分析a、b曲线变化的原因是()
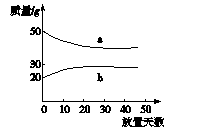
A.a升华、b冷凝 B.a挥发、b吸水
C.a蒸发、b潮解 D.a冷凝、b吸水
解析a表示稀硫酸中水挥发,质量减小;b表示浓硫酸吸水,质量增加。
答案B
6在接触法生产硫酸中,对于SO2的接触氧化反应有以下4个图,其中正确的是()
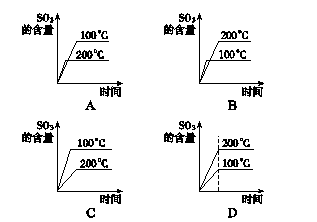
解析SO2的催化氧化是放热反应,故100 ℃时SO3的平衡浓度大,可排除B、D;又因为200 ℃时反应速率快,达到平衡所需时间短,故C错误,A正确。
答案A
7某制药厂尾气中含少量SO2气体,一般用NaOH溶液或氨水吸收,以防污染环境。分别用0.1 mol·L-1的NaOH溶液或同浓度的氨水处理相同量的尾气,两种方法所需吸收液的体积关系是()
A.NaOH溶液的体积大于氨水
B.NaOH溶液的体积等于氨水
C.NaOH溶液的体积小于氨水
D.无法判断
解析相同物质的量的NaOH和NH3·H2O吸收SO2的能力相同。
答案B
8日常生活、工农业生产、科学研究中涉及许多化学原理,下列有关实验原理的说法正确的是()
A.实验室可用浓硫酸和氯酸钾制氯气
B.2MgO![]() 2Mg+O2↑符合冶炼原理
2Mg+O2↑符合冶炼原理
C.除去甲烷中混有的乙烯,最好依次通过KMnO4溶液和浓硫酸
D.工业上制取NH3、HNO3、H2SO4的工艺中,都用了催化剂
解析实验室用浓盐酸和氯酸钾制氯气,而不用浓硫酸,因为浓硫酸没有还原性;由于MgO是高熔点的化合物,所以不能用电解MgO的方法冶炼Mg;当乙烯通过KMnO4酸性溶液时,会被KMnO4氧化生成CO2,和甲烷仍混在一起。故A、B、C错误。工业制NH3、HNO3、H2SO4的工艺中,都使用了催化剂,分别是铁触媒、Pt、V2O5,故选D。
答案D
9下图曾作为世界环境日的主要宣传画,这幅宣传画所提示的全球主要环境问题是()

A.酸雨
B.“温室效应”加剧,气温升高
C.臭氧空洞
D.森林锐减
解析地球温度升高主要是由“温室效应”造成的。
答案B
10使用化学手段,可以消除某些环境污染。下列主要依靠化学手段消除环境污染的是()
A.在燃料煤中添加氧化钙
B.将某些废旧塑料熔化后重新成型
C.用多孔吸附剂清除水面油污
D.把放射性核废料深埋于地下岩层
解析煤中加CaO主要是“固硫”,防止生成SO2污染环境。
答案A
11为了不使环境受到污染,下列各组中的两种物质可以同时倒入废液缸内的是()
A.Na2S溶液和盐酸
B.KMnO4溶液和盐酸
C.浓硫酸和Na2SO3
D.盐酸和NaHCO3
解析A中产生H2S,B中产生Cl2,C中产生SO2,均是大气污染物;D中产生CO2,可直接排入空气中。
答案D
12下列反应的离子方程式书写正确的是()
A.向氢氧化钠溶液中通入少量CO2
OH-+CO2![]()
![]()
B.用氨水吸收少量SO2
2NH3·H2O+SO2![]() 2
2![]() +
+ ![]() +H2O
+H2O
C.硝酸铝溶液中加入过量氨水
Al3++4NH3·H2O![]()
![]() +4
+4![]() +2H2O
+2H2O
D.向Fe2(SO4)3的酸性溶液中通入足量H2S
Fe3++H2S![]() Fe2++S↓+2H+
Fe2++S↓+2H+
解析NaOH溶液中通入少量CO2生成Na2CO3,A错;Al(OH)3不溶于NH3·H2O,故Al3+和NH3·H2O生成Al(OH)3,C错;D中电荷不守恒。
答案B
13合成氨的温度和压强通常控制在500 ℃以及2×107~5×107 Pa的范围,且进入合成塔的N2和H2的体积比为1∶3。经科学实验测定,在相应条件下反应所得NH3的平衡浓度(体积百分比)如下表所示:
| 2×107 Pa | 5×107 Pa | |
| 500 ℃ | 19.1 | 42.2 |
而实际从合成塔出来的混合气体中含氨约为15%,这表明()
A.表中所测数据有明显误差
B.生产条件控制不当
C.氨的分解速率大于预测值
D.合成塔中的反应并未达平衡
解析化工生产是一个连续的生产过程,在合成氨工业中,不断地向合成塔中通入N2、H2,同时分离出NH3,所以该可逆反应并未达到平衡状态。
答案D
14“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的副作用,下列反应不符合这一理念的是()
A.消除硝酸工业尾气的污染
NO+NO2+2NaOH![]() 2NaNO2+H2O
2NaNO2+H2O
B.工业上制CuSO4
2Cu+O2![]() 2CuO
CuO+H2SO4
2CuO
CuO+H2SO4![]() CuSO4+H2O
CuSO4+H2O
C.乙炔水化法制乙醛
CH![]() CH+H2O
CH+H2O![]() CH3CHO
CH3CHO
D.消除硫酸厂尾气
SO2+2NH3+H2O![]() (NH4)2SO3
(NH4)2SO3
解析乙炔水化法制乙醛的催化剂HgSO4对环境有副作用。
答案C
15关于1 mol·L-1的硫酸溶液的下列叙述, 不正确的是()
A.1 L该溶液中含溶质98 g
B.从10 mL该溶液中取出5 mL后,剩余溶液浓度仍为1 mol·L-1
C.将4.9 g浓硫酸加入盛有50 mL蒸馏水的烧杯中,充分混合就可配得该浓度的硫酸溶液
D.该浓度的硫酸具有酸的通性,但不具有强氧化性
解析配制1 mol·L-1的硫酸应取含4.9 g纯硫酸的浓硫酸稀释成50 mL溶液。
答案C
16向BaCl2溶液中通入SO2至饱和,此过程看不到现象;再向溶液中加入一种物质,溶液变浑浊。加入的这种物质不可能是()
A.FeCl3溶液 B.AlCl3溶液 C.Na2S溶液 D.AgNO3溶液
解析FeCl3可以将SO2氧化成H2SO4而产生BaSO4沉淀,加入Na2S会产生S沉淀,加入AgNO3会有AgCl沉淀,加入AlCl3无沉淀产生。
答案B
第Ⅱ卷(非选择题共52分)
二、简答题(本题包括2个小题,共20分)
17(12分)我国东部季风区某新建城市分布图如下图所示,城市的四周都有广阔地带,现要在城市附近建一座比较大型的火力发电厂:
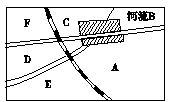
(1)请在图中A、B、C、D、E、F处选一最佳建厂处,说明理由。
(2)请你预测此工厂将有哪些方面对环境造成污染?
(3)请你用物理、化学、生物等方面的知识设计一个保护环境、控制污染的方案。
解析(1)应选在D处建厂。原因:①在季风区工厂应建在位于垂直于盛行风向的郊外,可尽量减少粉尘、有毒气体对居民区的污染;②在河的下游,水源充足;③紧靠铁路和公路,交通便利。
(2)有废气、废渣和废水。
(3)①利用该厂的废渣可在附近建一个矿渣水泥厂或砖厂,变废为宝;②根据产生废水的情况,在建厂的同时,建一个利用化学分解和生物降解的废水处理设备;③根据该厂将产生粉尘和有毒气体较严重的情况,在厂区里多栽一些如美人蕉、月季、丁香、菊花等能吸收有毒气体的植物,搞好厂区绿化保护。
答案(1)D处。①减少粉尘、有害气体对居民区的污染;②水源充足;③交通便利。(2)有废气、废渣、废水。(3)①在该厂附近建一个水泥厂或砖厂,变废为宝;②在建厂的同时,建一个利用化学分解和生物降解的废水处理设备;③在厂区多栽一些能吸收有毒气体的植物,搞好厂区绿化保护。
18(8分)比较硫酸工业、合成氨工业中两个重要反应:
2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-98.3 kJ·mol-1
2SO3(g);ΔH=-98.3 kJ·mol-1
N2(g)+3H2(g)![]() 2NH3(g);ΔH=-46.2 kJ·mol-1
2NH3(g);ΔH=-46.2 kJ·mol-1
根据勒夏特列原理,加热均不利于产物的生成。试分析工业上为什么均采用加热到500 ℃的高温。
答案工业生产采用500 ℃的高温是考虑了多方面的因素。在此温度下,反应速率较大,催化剂的活性最好,另外还要考虑某些反应物的化学活泼性(如氮气在常温下稳定)等。
三、填空题(本题包括2小题,共17分)
19(11分)硫酸工业生产应考虑综合经济效益问题。
(1)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1 t 98%的硫酸需消耗3.6×105 kJ的热量。请通过计算判断,若反应SO2(g)+![]() O2(g)
O2(g)![]() SO3;ΔH=-98.3 kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1)
SO3;ΔH=-98.3 kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1)
(2)CuFeS2是黄铁矿的另一成分,燃烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为 。
(3)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度的不同而变化(见下表)。
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 矿渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
已知CuSO4在低于660 ℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因 。
答案(1)SO2~SO3~H2SO4 放出的热量
98 g 98.3 kJ
1×106×98% g x
![]() =
=![]()
x=9.83×105 kJ
9.83×105 kJ-3.6×105 kJ=6.23×105 kJ
所以可向外界输出6.23×105 kJ的热量
(2)4CuFeS2+13O2![]() 4CuO+2Fe2O3+8SO2
4CuO+2Fe2O3+8SO2
(3)SO2转化为SO3是正反应放热的可逆反应,随温度的升高,平衡向逆反应方向移动,SO3的物质的量减少,所以CuSO4的量减少
20(6分)某化工厂排出的废水中含有氯气和硫酸,为了除去此废水中的游离氯,并使废水变为中性,供使用的试剂有碳酸钠和亚硫酸钠溶液,试回答:
(1)应先向废水中加入 溶液,离子方程式为 。
(2)然后再向废水中加入 溶液,离子方程式为 。
解析用亚硫酸钠除去Cl2会产生H+。要使废水变为中性,应先用Na2SO3溶液除去Cl2,然后再用碳酸钠除去H+。
答案(1)亚硫酸钠 Cl2+2![]() +2H2O
+2H2O![]() 4H++2Cl-+2
4H++2Cl-+2![]()
(2)碳酸钠 ![]() +2H+
+2H+![]() H2O+CO2↑
H2O+CO2↑
四、计算题(本题共2小题,共15分)
21(6分)煤是重要的化工原料,用煤作燃料,不仅存在浪费,而且因烟煤中含有硫的化合物(如FeS2),燃烧时会生成SO2气体造成环境污染。
设某具有30万户人口的中等城市,每户每天燃煤5 kg,这种煤中含FeS2 5%,燃烧时,设有90%的硫转化成二氧化硫,被排放到大气中。FeS2燃烧时化学方程式如下:
4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
问:(1)燃烧1 t煤,可产生多少千克的SO2?
(2)该中等城市如果全部以上述的煤作燃料,每年(按365天计算)将有多少吨SO2排放到大气中?
解析(1)设产生SO2的质量为x,根据硫元素守恒,得下列关系式:
FeS2 ~ 2SO2
120 2×64
1 t×103 kg·t-1×5%×90% x
x=48 kg
(2)由(1)可知1 t煤燃烧时产生SO2 48 kg,即0.048 t,一年烧煤的质量=0.005 t×30×104×365=5.475×105 t
所以一年产生的SO2的质量=5.475×105×0.048 t=26280 t
答案(1)48 kg (2)26280 t
22(9分)含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的![]() 还原为N2,从而消除污染。其反应的离子方程式是:
还原为N2,从而消除污染。其反应的离子方程式是:
6![]() +10Al+18H2O
+10Al+18H2O![]() 3N2↑+10Al(OH)3+6OH-
3N2↑+10Al(OH)3+6OH-
某化学兴趣小组的同学经过探究发现还有两条途径:
(1)金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。金属镁是由海水中提取的MgCl2通过电解制得的。若要除去1 m3废水中0.3 mol的![]() ,则至少需要含0.5%(质量分数)MgCl2的海水多少千克?
,则至少需要含0.5%(质量分数)MgCl2的海水多少千克?
(2)将甲醇加入含![]() 的废水中也可消除氮的污染,它可在一种微生物作用下发生反应:
的废水中也可消除氮的污染,它可在一种微生物作用下发生反应:
6![]() +6H++5CH3OH
+6H++5CH3OH![]() 3N2↑+5CO2↑+13H2O
3N2↑+5CO2↑+13H2O
若某废水用上述方法处理时,![]()
![]() N2的转化率为a%,那么每天处理此含
N2的转化率为a%,那么每天处理此含![]() 为b g·L-1的废水V m3(密度1 g·cm-3),需要甲醇多少千克?(要求写出解题步骤,运算过程中的数据及最后结果只需写出运算式,不必化简)
为b g·L-1的废水V m3(密度1 g·cm-3),需要甲醇多少千克?(要求写出解题步骤,运算过程中的数据及最后结果只需写出运算式,不必化简)
解析常见的工业计算问题是学生必须掌握的内容之一,不仅考查化学基础知识,还考查学生的推理和科学运算能力。
答案(1)根据题意写出Mg代替铝参加反应的离子方程式为:
2![]() +5Mg+6H2O
+5Mg+6H2O![]() N2↑+5Mg(OH)2+2OH-
N2↑+5Mg(OH)2+2OH-
设海水的质量为x,则根据转化关系:
2![]() ~5Mg~5MgCl2
~5Mg~5MgCl2
2 mol 5×95 g
0.3 mol x×103 g·kg-1×0.5%
![]() =
=![]()
解得:x=14.25 kg
(2)设需要甲醇的质量为y,
根据转化关系
6![]() ~
5CH3OH
~
5CH3OH
6×62 5×32
b g·L-1×V m3×103 L·m-3×a% y×103 g·kg-1
![]() =
=![]()
解得:y=![]() 。
。