物质的量及物质的量浓度单元过关题
姓名_______________
第一卷(选择题,共50分)
一、选择题(每题有一个正确答案,每题2分,共20分)
1.摩尔是 ( )
A.国际单位制的一个基本物理量 B.表示物质质量的单位
C.计量微观粒子的物质的量的单位 D.表示![]() 个粒子的集体
个粒子的集体
2.下列各组物理量中,都不随取水量的变化而变化的是 ( )
A.水的沸点;蒸发水所需热量
B.水的密度;水中通入足量![]() 后溶液的pH值
后溶液的pH值
C.水的体积;电解水所消耗的电量
D.水的物质的量;水的摩尔质量
3.下列各物质中所含原子个数由大小的顺序正确的是 ( )
①0.5mol氨气;②标准状况下22.4L氦气;③4℃时9mL水;④0.2mol磷酸
A.①④③② B.④③②① C.②③④① D.①④②③
4.在两个容积相同的容器中,一个盛有HCl气体,另一个盛有![]() 和
和![]() 的混合气体。在同温同压下,两容器内的气体一定具有相同的 ( )
的混合气体。在同温同压下,两容器内的气体一定具有相同的 ( )
A.原子数 B.密度 C.质量 D.质子数
5.超导材料为具有零电阻及反磁性的物质,以![]() 、
、![]() 和CuO为原料、经研磨烧结可合成一种高温超导物
和CuO为原料、经研磨烧结可合成一种高温超导物![]() ,现欲合成0.5 mol此高温超导物,依化学剂量比例.需取
,现欲合成0.5 mol此高温超导物,依化学剂量比例.需取![]() 、
、![]() 和CuO的物质的量分别为 ( )
和CuO的物质的量分别为 ( )
A.0.50,0.50,0.50 B.0.25,1.0,1.5
C.0.50,1.0,1.5 D.1.0,0.25,0.17
6.在一定温度下,已知有关某饱和溶液的一些数据:①溶液的质量,②溶剂的质量,③溶液的体积,④溶质的摩尔质量,⑤溶质的溶解度,⑥溶液的密度.利用下列各组数据计算该饱和溶液的物质的量浓度,不能算出的一组是 ( )
A.④⑤⑥ B.①②③④ C.①④⑥ D.①③④⑤
7.KNO3的溶解度在80℃时为mg,20℃时为ng,20℃时饱和溶液中KNO3的质量分数为p%,则下列数据关系正确的是 ( )
A.m<n<p B.m>n>p C.n>m>p D.p>m>n
8.由CO、H2和O2组成的混和气体60mL,在一定条件下恰好完全反应,测得生成物在101kPa120℃下对空气的相对密度为1.293,则原混和气体中H2所占的体积分数为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
9.下列各组中两种气体的分子数一定相等的是 ( )
A.温度相同、体积相同的O2和N2
B.质量相等、密度不等的N2和C2H4
C.体积相同、密度不相等的CO和C2H4
D.压强相同,体积相同的O2和H2
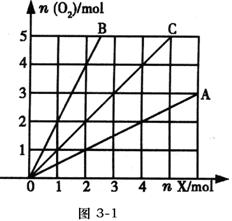 10.如图3—1所示,横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量n(X),纵坐标表示消耗
10.如图3—1所示,横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量n(X),纵坐标表示消耗![]() 的物质的量n(
的物质的量n(![]() ),A和B是两种可燃气体,C是A和B的混合气体,则C中n(A):n(B)为 ( )
),A和B是两种可燃气体,C是A和B的混合气体,则C中n(A):n(B)为 ( )
A.2:1 B.1:2
C.1:1 D.任意比
二、选择题(每题有1-2个正确答案,每题3分,共30分)
11.下列叙述正确的是 ( )
A.同温同压下,相同体积的物质,它们的物质的量必相等
B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.等体积、等物质的量浓度的强酸中所含的H+数一定相等
12.若以![]() 和
和![]() 分别表示浓度为
分别表示浓度为![]() 和
和![]() 氨水的质量分数,且知2a=b,则
氨水的质量分数,且知2a=b,则
下列推断正确的是(氨水的密度比纯水的小) ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
13.下列实验中,①配制—定物质的量浓度的溶液 ②pH试纸的使用 ③过滤 ④蒸发 ⑤溶解,均用到的仪器是 ( )
A.烧杯 B.漏斗 C.玻璃棒 D.胶头滴管
14.现有两种不含结晶水的盐,它们在20℃和60℃时的溶解度分别是:
|
| 20℃ | 60℃ |
| A的溶解度 | 35.7g | 46.4g |
| B的溶解度 | 31.6g | 110g |
下列说法中,正确的是 ( )
A.两种盐在某一温度下具有相同的溶解度
B.若把110gB的饱和溶液从60℃降到20℃,析出的B是78.4g
C.在20℃时,A、B都可以配成25%的不饱和溶液
D.若要使A、B混合物分离,可采用重结晶法
15.用蒸汽密度法测定物质的相对分子质量是一种常用的方法。现测得0.3g某挥发性液体化合物样品在挥发时排出的空气在标准状况下是40mL,则该化合物的相对分子质量是 ( )
A.85 B.168 C.310 D.340
16.下列实验操作中所用仪器合理的是 ( )
A.用25mL的碱式滴定管量取14.80mLNaOH溶液
B.用100mL量筒量取5.2mL盐酸
C.用托盘天平称取25.20g氯化钠
D.用100mL容量瓶配制![]() 盐酸
盐酸
17.将a%的酒精和(100-a)%的乙醇溶液等体积混和后所得乙醇溶液的质量分数可能为 ( )
A.大于50% B.小于50%
C.小于或等于50% D.大于或等于50%
18.为检验某病人血液中的含钙量,现取10mL血液样品稀释后用草酸铵[![]() ]处理成草酸钙沉淀,将此沉淀溶于过量的稀
]处理成草酸钙沉淀,将此沉淀溶于过量的稀![]() 中,然后用
中,然后用![]() 溶液(生成
溶液(生成![]() 、
、![]() 、
、![]() )恰好消耗1.6mL,则该病人血液中含钙量为 ( )
)恰好消耗1.6mL,则该病人血液中含钙量为 ( )
A.2.4 g/L B.8 g/L C.6 g/L D.12 g/L
19.有一未知浓度的盐酸25mL,在加入0.5 mol·L—1的AgNO3 溶液25mL后,改加NaOH溶液,结果用去1.0 mol·L—1NaOH溶液25mL恰好完全中和,则盐酸的物质的量浓度为………………………………………………………………………( )
A.0 .5 mol·L—1 B.1.0 mol·L—1 C.1.5 mol·L—1 D.2.0 mol·L—1
20.某温度下,将Cl2通入NaOH溶液中,反应得到NaCI、NaCIO、NaClO3 的混合液,经测定CIO—与CIO3—的浓度之比为1∶3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为……………………………………………( )
A.21∶5 B.11∶3 C.3∶1 D.4∶1
第二卷(填空题,简答题,共50分)
三、21.(9分)已知氨气跟氯气可迅速反应生成氯化铵和氮气。当转移的电子总数为a个时,生
成的氮气的物质的量bmol.
(1)写出该反应配平的化学方程式:
(2)该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为 。×
(3)阿伏加德罗数常数为(用含a、b的代数式表示) 。
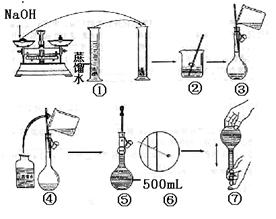
22.(12分)某学生用已知质量yg的表面皿,准确称取w g NaOH固体。他在托盘天平的右盘上放(w+y)g砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边(如右图所示),下面他的操作应该是 使 。
若称取的w g NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制500mol·L-1NaOH溶液过程示意图中有错误的是(填操作序号) 。
|
23.(10分)(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图3—2所示的游码尺上画出游码的位置(画“”表示)。
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 |
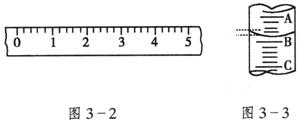
(2)图3—3表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中的液体的体积是__________mL。
(3)配制![]() 的硫酸溶液200mL所需的玻璃仪器为___________。
的硫酸溶液200mL所需的玻璃仪器为___________。
24.(12分)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定的方法,具体步骤为:
(1)将固体NaCl细粒干燥后,准确称取mg NaCl固体并转移到定容仪器A中;
 (2)用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积
(2)用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积![]() 。
。
请回答下列问题:
①步骤(1)中A仪器最好使用___________。(填序号)
A.量筒 B.烧杯 C.容量瓶 D.试管
②步骤(2)中用酸式滴定管还是用碱式滴定管______________,理由是_____________。
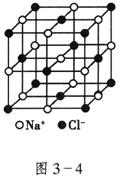
③能否用水代替苯__________,理由是____________。
④已知NaCl晶体中,靠得最近的![]() 与
与![]() 间的平均距离为a cm(如图3—4),用上述测定方法测得的阿伏加德罗常数
间的平均距离为a cm(如图3—4),用上述测定方法测得的阿伏加德罗常数![]() 的表达式为_______________。
的表达式为_______________。
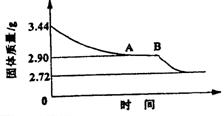
25.(15分)某校课外活动小组为测定生石膏的组成(CaSO4·xH2O),即测定x值,做如下实验:将生石膏放在坩埚中加热,加热前、后都进行称量。随实验次数增加,加热时间不断延长,最后整理加热前后固体质量数据如下表(下右图为根据数据绘制的图象):
| 实验顺序 | 加热前(g) |
| ||
| 1 | 3.44 | 3.26 | ||
| 2 | 3.44 | 3.12 | ||
| 3 | 3.44 | 2.90 | ||
| 4 | 3.44 | 2.90 | ||
| 5 | 3.44 | 2.80 | ||
| 6 | 3.44 | 2.78 | ||
| 7 | 3.44 | 2.72 | ||
| 8 | 3.44 | 2.72 |
(1)利用实验数据,通过计算推断生石膏的化学式。
(2)通过计算解释图象中产生AB段的原因。
(3)若将所得的固体残渣继续升温灼烧,发现质量还会减轻,简述你认为可能的原因。
26.(6分)标准状况下11.2L,由CO和![]() 组成的混合气体的质量为7.2g,则混合气体的平均摩尔质量为_______;此混合气体完全燃烧消耗氧气的体积(标准状况)为___________L;将燃烧产物通过足量过氧化钠后,固体增重___________g。
组成的混合气体的质量为7.2g,则混合气体的平均摩尔质量为_______;此混合气体完全燃烧消耗氧气的体积(标准状况)为___________L;将燃烧产物通过足量过氧化钠后,固体增重___________g。
27.(8分)化合物A是一种不稳定的物质,它的分子组成可用![]() 表示。10mLA气体能分解生成15mL
表示。10mLA气体能分解生成15mL![]() 和10mL
和10mL![]() (同温、同压)。
(同温、同压)。
(1)A的化学式是___________。推断理由是___________。
(2)已知A分子中x个氧原子呈…O—O—O…链状排列,则A分子的电子式是_________,A分子的结构式是________。
28.(12分)在配制物质的量浓度溶液时,下列操作出现的后果是(填:“溶液浓度不准确”、“偏低”、“偏高”、“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体。_____________。
(2)配制氢氧化钠溶液时,溶液不能澄清,溶质少量不溶解。____________。
(3)配制氯化钠溶液时,容量瓶中有少量水。______________。
(4)定容时,液面上方与刻度相齐时,停止加水。__________。
(5)配制好溶液后,容量瓶未塞好,洒出一些溶液。_____________。
(6)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线________________。
答案
21.(1)3NH3+3Cl2 6NH4Cl+N2
(2)3:2 (3)![]()
22.继续加入样品 指针指在标尺的中间 ①③⑥;
23.(1)下表为取用砝码情况,图3-(1)所示为游码尺上的游码位置。
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 | ↓↑ | ↓ | ↓↑ | ↓ | ↓↑ |
(2)3.2 (3)10mL量筒,200ml容量瓶,烧杯,玻棒,胶头滴管
24.①C ②酸式滴定管;碱式滴定管的橡胶因溶于苯而变形
③不能;![]() 溶于水,不能测出
溶于水,不能测出![]() 固体的体积 ④
固体的体积 ④![]()
25.(1) CaSO4·xH2O CaSO4 +
xH2O
136+18x 136 18x
3.44 2.72 0.72
x=2 CaSO4·2H2O
|
CaSO4·2H2O CaSO4
· yH2O+(2-y)H2O
172 136+18y
3.44 2.90
![]()
加热过程中生石膏转化成相对稳定的2CaSO4·H2O,所以图象中存在一段时间内质量不
变的AB段。 (3)CaSO4受高温灼烧还可以继续分解放出气体。
26.![]() ;5.6;7.2
;5.6;7.2
27.(1)![]() ;由阿伏加德罗定律,不难写出方程式:
;由阿伏加德罗定律,不难写出方程式:![]() ,再由质量守恒定律可知:2x=6,2y=4,解之,x=3,y=2
,再由质量守恒定律可知:2x=6,2y=4,解之,x=3,y=2
(2)![]() ;F—O—O—O—F
;F—O—O—O—F
28.(1)偏低 (2)偏低 (3)无影响 (4)偏高 (5)无影响 (6)偏低