2005-2006学年望江县高三年级考试化学月考试题
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分100分。考试时间100分钟。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5
Na-23 Ca-40 Zn-65 Mn-55
一.选择题(每题2分,共16分,每题只有1个符合要求的选项)
1.下列关于过氧化氢的说法正确的是
A. 过氧化氢具有杀菌消毒作用,是强酸
B. 过氧化氢是离子化合物
C. 过氧化氢可以发生分解反应
D.过氧化氢是水的同分异构体
2.下列晶体中,不属于原子晶体的是
A.干冰 B.水晶 C.晶体硅 D.金刚石
3.1993年报导,合成了迄今为止世界上最大的烃,即C1134H1146。下列有关叙述正确的是
A.具有高硬度 B.属于高分子化合物
C.属于原子晶体 D.常温下呈固体
4.向50mLl8mo1.L-1H2SO4溶液中加入足量的Cu片并加热。充分反应后,被还原的H2SO4的物质的量为
A.小于0.45mol B.等于0.45mol
C.在0.45mol和0.90mol之间 D.大于0.90mol
5.被称为万能还原剂的NaBH4,溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑。下列说法正确的是
A.NaBH4既是氧化剂又是还原剂 B.NaBH4是氧化剂,水是还原剂
C.硼元素被氧化,氢元素被还原 D.氢气既是氧化产物又是还原产物
6.下列说法正确的是
A.全部由非金属元素形成的化合物中只含有共价键
B.分子晶体的熔点较低,因为分子晶体中有化学键
C.金属在常温下都以晶体形成存在
D.金属晶体中,自由电子几乎均匀分布在整个晶体中,被许多金属离子共用
7.能正确表示下列反应的离子方程式是
A.甲酸钠溶液和盐酸反应:HCOO—+ H+ == HCOOH
B.硫化钠的第一步水解:S2— + 2H2O ![]() H2S +
2OH—
H2S +
2OH—
C.醋酸钡溶液和硫酸反应:Ba2+ + SO42— == BaSO4↓
D.氢氧化钙溶液和碳酸氢镁反应:Ca2+ + OH—+ HCO3— == CaCO3↓+ H2O
8.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是
A.3Cl2 + 6FeI2 == 2FeCl3 + 4FeI3 B.Cl2 + FeI2 == FeCl2 + I2
C.Co2O3 + 6HCl == 2CoCl3 + 3H2O D.2Fe3+ + 2I— == 2Fe2+ + I2
二.选择题(每题2分,共20分,每题只有1个符合要求的选项)
9.已知如下两个热化学方程式
C(s)+O2(g)===CO2(g);△H=-393.5kJ/mol
2H2(g)+O2(g)===2H2O(g);△H=-483.6 kJ/mol
现有0.2mol炭粉和氢气组成的悬浮气体、固体混合物在氧气中完全燃烧,共放出63.53kJ热量。则炭粉与氢气的物质的量之比是
A.1:1 B l:2 C.2:3 D.3:2
10.不能用来说明金属X比金属Y还原性强的是
A.把X-Y合金置于潮湿空气中,X先腐蚀
B.X原子最外层电子数比Y原子最外层电子数少
C.X能从Y的盐溶液中把Y置换出来
D.X的氢氧化物比Y的氢氧化物的碱性强
11.在体积可变的密闭容器中,反应mA(气) + nB(固) ![]() pC(气)达到平衡后,压缩容器的体积,
pC(气)达到平衡后,压缩容器的体积,
发现A的转化率随之降低。下列说法中,正确的是
A.(m + n)必定小于p B.(m + n)必定大于p C.m 必定小于p D.m 必定大于p
12.相同体积的pH =3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是
A.弱酸溶液产生较多的氢气 B.强酸溶液产生较多的氢气
C.两者产生等量的氢气 D.无法比较两者产生氢气的量
13.对于某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32—
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42—
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
14.水蒸气中常含有部分(H2O)2,要确定(H2O)2的存在,可采用的方法是
A.1L水蒸气冷凝后与足量金属钠反应,测产生氢气的体积
B.1L水蒸气通过浓硫酸后,测浓硫酸增重的质量
C.该水蒸气冷凝后,测水的pH
D.该水蒸气冷凝后,测氢氧原子比
15.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3—)>c(OH—)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3—)>c(OH—)>c(H+)
D.N3—与CO2含相等电子数
16.欲使0.1mol/L的 NaHCO3溶液中c(H+)、c(CO32—)、c(HCO3—) 都减少,其方法是
A.通入二氧化碳气体 B.加入氢氧化钠固体
C.通入氯化氢气体 D.加入饱和石灰水溶液
17.某500mL溶液中含0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol 铁粉,待Fe3+完全还原后
溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)
A.0.4 mol/L B.0.6mol/L C.0.8 mol/L D.1.0 mol/L
18.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1:1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1:7 B.1:9 C.1:5 D.2:9
三.(本题包括4小题,共32分)
19.(8分)有6瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜、碳酸钠。现只提供蒸馏水,通过下面的实验步骤即可鉴别它们。请填写下列空白:
(1)各取适量固体试剂分别加入6支试管中,加入适量蒸馏水,振荡试管,观察到的现象是:
。
被检出的物质的化学式(分子式)是 。
(2)分别取未检出的溶液,往其中加入上述已检出的溶液,观察到的现象和相应的离子方程式是:
被检出的物质的化学式(分子式)是
(3)鉴别余下未检出物质的方法和观察到的现象是:
。
20.(8分)某化学课外小组用右图装置制取溴苯。
先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应
 器A(A下端活塞关闭)中。
器A(A下端活塞关闭)中。
⑴ 写出A中反应的化学方程式
___________________________________
⑵ 观察到A中的现象是______________________________
________________________________________________。
⑶ 实验结束时,打开A下端的活塞,让反应液流入B中,
充分振荡,目的是________________________________,
写出有关的化学方程式_____________________________。
⑷ C中盛放CCl4的作用是____________________________。
⑸ 能证明苯和液溴发生的是取代反应,而不是加成反应,可
向试管D中滴入AgNO3溶液,若产生淡黄色沉淀,则能
证明。另一种验证的方法是向试管D中加入__________,
现象是___________________________________________。
21.(8分)通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ KJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
 ⑴ 比较下列两组物质的熔点高低
(填>或<)
⑴ 比较下列两组物质的熔点高低
(填>或<)
SiC______ Si; SiCl4 ______ SiO2
⑵ 右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶ 工业上高纯硅可通过下列反应制取:
SiCl4 (g) + 2H2(g) ![]() Si(s) +
4HCl(g)
Si(s) +
4HCl(g)
该反应的反应热△H = ___________ KJ/mol
22.(8分)下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。

请按要求回答:
⑴ 写出B的化学式_______________,G的电子式_________________。
⑵ 反应①的离子方程式为_______________________________________。
⑶ 反应②进行的条件是___________________,_____________________。
⑷ 反应③的化学方程式为________________________________________。
四.(本题包括2小题,共16分)
23.(6分)某有机化合物A的相对分子质量(分子量)大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
⑴ 该化合物分子中含有几个氧原子,为什么?
⑵ 该化合物的相对分子质量(分子量)是___________________。
⑶ 该化合物的化学式(分子式)是______________________。
![]()
⑷ 该化合物分子中最多含________个 官能团。
24.(10分)环己烯可以通过丁二烯与乙烯发生环化加成反应得到:
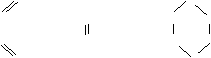 CH2
CH2
CH2
CH2
![]()
![]()
![]() CH + CH2 → CH CH2 (也可表示为
CH + CH2 → CH CH2 (也可表示为 ![]() )
)
CH CH2 CH CH2
CH2 CH2
丁二烯 乙烯 环己烯
实验证明,下列反应中反应物分子的环外双键比环内双键更容易被氧化:
![]()
![]()
![]()
现仅以丁二烯为有机原料,无机试剂任选,按下列途径合成甲基环己烷:
丁二烯→① A →② B →③ C →④ D →⑤![]() △
△
请按要求填空:
(1)A的结构简式是 ;B的结构简式是 。
(2)写出下列反应的化学方程式和反应类型:
反应④ ,反应类型 。
反应⑤ ,反应类型 。
五.(本题包括2小题,共16分)
25.(6分)在一定条件下,使H2和O2的混合气体26 g充分发生反应。所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2 g 。求原混合气体中O2和H2的质量。
26.(10分)过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO。
![]() ⑴ 称取0.542g过氧化钙样品,灼热时发生如下反应:
⑴ 称取0.542g过氧化钙样品,灼热时发生如下反应:
2CaO2·XH2O 2CaO + O2↑ +2XH2O,得到的O2在标准状况下体积为67.2mL,
该样品中CaO2的物质的量为________________。
⑵ 另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+
全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g
① 试计算样品中CaO的质量。
② 试计算样品中CaO2·XH2O 的X值。
参考答案:
一.选择题
1.C 2.A 3.D 4.A 5.D 6.D 7.A 8.A
二.选择题
9.A 10.B 11.C 12.A 13.C 14.AB 15.B 16.D 17.C 18.A
三.
19.(1) 6种固体全部溶解,5支试管中得到无色溶液,1支试管中得到蓝色溶液CuSO4
(2) 1支试管中有白色沉淀生成 Ba2++SO2===BaSO4↓
2支试管中有蓝色沉淀生成 Cu2++2OH-=Cu(OH)2↓ Cu2++CO32-=CuCO3↓+BaCl2
(3 ) (ⅰ) 分别取(2)中能产生蓝色沉淀的两种溶液,向其中加入BaCl2溶液,有白色沉淀生成的是Na2CO3溶液,无沉淀生成的是NaOH溶液。
(ⅱ) 分别取少量未检出的溶液,往其中加入NaOH溶液,无明显现象的是Na2SO4溶液,有刺激性气味气体产生的是(NH4)2SO4溶液
20.⑴ C6H6 +Br2 → C6H5Br + HBr
⑵ 反应液微沸 有红棕色气体充满A容器
⑶ 除去溶于溴苯中的溴
Br2 + 2NaOH → NaBr + NaBrO + H2O 或3Br2 + 6NaOH → 5NaBr + NaBrO3+ 3H2O
⑷ 除去溴化氢气体中的溴蒸气
⑸ 石蕊试液,溶液变红色
21.⑴ > < ⑵ 如下图 ⑶ +236

22.⑴ Al  ⑵ Al3+ + 3AlO2— + 6H2O == 4Al(OH)3↓
⑵ Al3+ + 3AlO2— + 6H2O == 4Al(OH)3↓
⑶ 光照,过量Cl2 ⑷ Al4C3 +12H2O == 4Al(OH)3 + 3CH4↑
四.
23.⑴ 4个,因为化合物的相对分子质量在110~150之间,且含氧的质量分数为47.76%,所以氧原子的个数只能为4
⑵ 134
⑶ C5H10O4
⑷ 1
24.(1)![]() ;
;![]() 。
。
(2)![]()
![]()
![]() +H2O,消去反应;
+H2O,消去反应;
![]() +H2
+H2![]()
![]() ,加成反应。
,加成反应。
五.
25.原混合气体中氢气的质量为2g,氧气的质量为24g;或者氢气的质量为10g,氧气的质量为16g;
26.⑴ 0.006mol
⑵ ① n(CaO2) = 0.006mol,n(Ca2+) = 0.007mol,m(CaO) = 0.056g。
② n(H2O) = 0.003mol,X = 1/2