平定一中高三第二次月考化学试题
(时间90分钟 总分100分)
可能用到的原子量:H—1 C—12 O—16 Na—23
第Ⅰ卷(选择题 共51分)
一、选择题(本题包括18小题,每小题3分,共51分。每小题只有一个选项符合题意)
1.我国科学家为一个比头发丝还细的“钴酞菁”分子恢复了磁性,由此创造了一项“世界第一”,“钴酞菁”分子“个头”仅为1.3纳米,其结构与性质和人体内的血红素及植物体内的叶绿素非常相似,在光电子器件、生物技术等方面具有广泛而重要的应用与研究价值。下列说法正确的是
A、“钴酞菁”的溶液没有胶体的性质
B、纳米材料可以应用于所有化工领域
C、现在纳米器件都是无所不能的胶体
D、此工作使利用局域的化学反应来改变和控制分子的物理性质成为现实
2.高一新教材中的一个演示实验:用脱脂棉包住0.2gNa2O2粉末,放在石棉网上,在脱脂棉上滴加几滴水;可以观察到脱脂棉剧烈燃烧起来。由实验现象所得出的结论正确的是
A.Na2O2与H2O反应是一个放热反应
B.Na2O2与H2O反应中有氢气生成
C.Na2O2与H2O反应中有氢氧化钠生成
D.Na2O2与H2O反应中有中间产物H2O2生成
3.RO![]() +2Rx+6H+===3R+3H2O是某同学作业中的一个离子方程式,其中Rx所带电荷模糊不清,若R所带的电荷用x表示,则x应是
+2Rx+6H+===3R+3H2O是某同学作业中的一个离子方程式,其中Rx所带电荷模糊不清,若R所带的电荷用x表示,则x应是
A.“+” B.“2-” C.“3+” D.“4-”
4.在强酸溶液中,下列各组离子能够大量共存的是
A.Mg2+、Ca2+、HCO3-、Cl- B.Na+、AlO2-、Cl-、SO42-
C.K+、Fe2+、SO42-、Br- D.Fe2+、Ca2+、Cl-、NO3-
5.氰气的化学式为(CN)2,它的性质和卤素相似,称为拟卤素,对其性质和有关化合物性质的叙述不正确的是
A. NaCN 和AgCN都易溶于水
B.HCl和HCN都易形成白雾
C.MnO2可与HCN反应生成(CN)2
D.(CN)2和NaOH溶液反应生成NaCN、NaCNO 和H2O
6.下列数据对应的是物质的熔点(℃),据此作出的下列判断中错误的是
| NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 801 | 920 | 1291 | 190 | -107 | 2073 | -57 | 1723 |
A、铝的化合物的晶体中有离子晶体
B、同族元素中的氧化物可形成不同类型的晶体
C、表中只有BCl3和干冰是分子晶体
D、不同元素的氧化物可形成相同类型的晶体
7.下列物质性质递变规律正确的是
A.酸性:HFO4>HClO4>HBrO4>HIO4 B.稳定性:HF>HCl>HBr>HI
C.酸性:HF>HCl>HBr>HI D.还原性:I—>Br—>Cl—>S2—
8.下列各组物质的晶体、化学键类型相同,晶体类型也相同的是
A.SO2和SiO2 B.CO2和NaCl C.NH4Cl和HCl D.H2O2和C3H6
9.用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液pH值减小的是
A. ![]() B.
B.
![]() C.
C.
![]() D.
D.
![]()
10.已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是
A.上述实验证明氧化性:MnO4—>Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
11.下列表示的离子方程式正确的是
A.NH4NO3溶液与氢氧化钠共热:H++OH-===H2O
B. 金属铝溶于盐酸中:![]()
![]()
![]()
C.NaOH溶液与NaHCO3溶液混合:OH-+H+===H2O
D.Al(OH)3固体可溶于稀硫酸中:Al(OH)3+3H+===Al3++3H2O
12.除去下列溶液中的杂质(括号内是杂质),各选项中所用试剂错误的是
A.NaOH〔Ba(OH)2〕:使用Na2SO4溶液 B.KOH(K2SO4):使用Ba(OH)2溶液
C.NaCl(Na2SO4):使用Ba(NO3)2溶液 D.HNO3(HCl):使用AgNO3溶液
13.两种有机物以一定比例混合,一定条件下在aL O2(足量)中燃烧,充分反应后恢
复到原状态,再通过足量Na2O2层,得到气体仍是aL,下列混合有机物中符合此条件
的是
A. CH4 C2H4 B. CH3OH CH3COOH
C. C2H6 HCHO D. HCHO CH3COOCH3
14.氢气是人类最理想的能源。已知在25℃、101kPa下,1 g氢气完全燃烧生成液态水时放出热量142.8 kJ,则下列热化学方程式书写正确的是
A.2H2 + O2
2H2O;△H = – 142.9 kJ/mol
B.2H2(g) + O2(g)
2H2O(l);△H = – 142.9 kJ/mol
C.2H2(g) + O2(g)
2H2O(l);△H = – 571.6 kJ/mol
D.2H2(g) + O2(g)
2H2O(l);△H = + 571.6 kJ/mol
1
15.NA代表阿伏加德罗常数,以下说法正确的是
A.在标准状况下,2.24L苯中含有0.6mol碳原子
B.1L pH=1的硫酸溶液中含有0.2NA个氢离子
C.在1L 0.1 mol/L的HCOOH溶液中,所含HCOO—粒子数为0.1NA个
D.标准状况下,以任意比例混合的乙烷和乙烯混合物22.4L,所含分子数约为NA个
16. 将标准状况下,将VL A气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为
A.![]() B.
B.![]()
C.![]() D.100VρM/(MV+2240)
D.100VρM/(MV+2240)
17.密闭容器中充有H2、O2、Cl2,充分燃烧后无气体剩余,冷却后得以到的溶液中溶质的质量分数为33.6%,则原溶液中H2、O2、Cl2的体积比为
A.9 :4 :2 B.9 :4 :1 C.2 :1 :1 D.2 :1 :2
第II卷(选择题 共49分)
二、(本题包括1小题,共12分)
18.(12分)我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:

已知:沉淀池中发生反应的化学方程式为CO2+NH3+NaCl+H2O NaHCO3↓+NH4Cl
(1)写出煅烧炉中发生反应的化学方程式
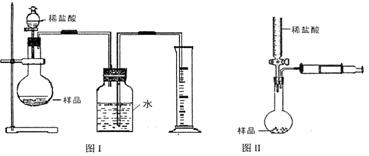
(2)该实验得到的纯碱中含有氯化钠。甲同学设计的测定样品纯碱含量的方法如图Ⅰ,试回答:
|
①写出烧瓶中发生反应的离子方程式
②该设计方案会造成误差,其原因可能为(写两种即可)
、
③若读取量筒中水的体积时俯视,由此会造成实验结果 (填偏高、偏低或不影响)。
(3)乙同学设计的测定样品中纯碱含量的方法如图Ⅱ,试回答:
①检查该装置气密性的方法为:
②设滴定管的起始读数为a mL,终了读数为b mL,注射器测定排出的气体为c mL(标准状况),称得样品质量为m g,则原样品中碳酸钠的质量分数表达式为 (用含a、b、c、m的代数式表示)。
三、(本题包括4小题,共32分)
19.(4分)一个体重50 kg的健康人含铁元素2 g。这2 g铁以Fe2+和Fe3+的形式存在。Fe2+易被吸收,给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用Vc可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)人体中经常进行Fe2+与Fe3+的转化,可表示为:![]() 在过程A中,Fe2+作_________剂;过程B中,Fe3+被_________。
在过程A中,Fe2+作_________剂;过程B中,Fe3+被_________。
(2)“服用Vc可使食物中的Fe3+转化为Fe2+”这句话指出,Vc在这一反应中作_________,具有_________性。
20.(6分) 有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
试根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是_________,一定不含的物质是_________________,可能含有的物质是_________________。(以上各种物质均写化学式)
(2)写出②步变化的离子方程式。
21.(10分)如下图所示的装置,C、D、E、F、X、Y都是惰性电极。
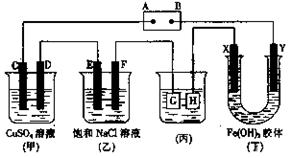 |
将电源接通后,向乙中滴入酚酞液,在F极附近显红色。试回答以下问题:
(1) 电源A极的名称是_______。
(2)甲装置中电解反应的总化学方程式是 。
(3)如果收集乙装置中产生的气体,两种气体的体积比是______________。
(4)欲用丙装置给铜镀银,G应该是_______(填“铜”或“银”)。
(5)装置丁中的现象是_________________________________ _____ 。
22.(5分) A、B、C是周期表中短周期元素间组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如下的关系:
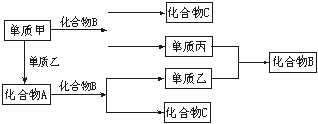
试完成下列空白:
(1)A、B、C的化学式分别为_________、_________、_________。
(2)单质甲与化合物B反应的离子方程式为:_______________________________。
(3)在A、B、C三种化合物中,必定含有的元素是_________(用甲、乙、丙表示)。
四、(本题包括1小题,共10分)
23.(5分)某链烃A有下列的转化关系
|
|
|
|
|
![]()
![]()
![]()
![]()
|
|
|
已知:D的式量为60,它的水溶液能使石蕊试液变红,G是高分子化合物。
⑴请用结构简式表示下列物质:A是 ,G是 。
⑵ D物质的官能团
(3) F→G的反应类型属于 反应。
(4)某有机物M与D互为同分异构体;M能发生银镜反应,也能与金属钠反应,该有机物的可能的结构简式
24、(7分)有硫酸钠和碳酸镁的混合物,用40mL 盐酸完全溶解后,在标准状况下收集到0.448L二氧化碳。向反应后的溶液中加入含有0.025mol氢氧化钡的溶液,可得到5.82g沉淀,此时溶液的pH=12,体积为200mL。试求:
①.原混合物中MgCO3的质量
②.得到的沉淀中硫酸钡的质量
③.盐酸的物质的量浓度
 平定一中2006年下期高三第二次月考
平定一中2006年下期高三第二次月考
化学试题答题卡
|
第Ⅰ卷(选择题 共51分)
一、选择题(本题包括18小题,每小题3分,共51分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |
| 答案 |
第Ⅱ卷(非选择题 共49分)
|
|
2006年平定一中高三第二次月考化学参考答案
1D 2A 3B 4C 5A 6C 7B 8D 9A 10A 11D 12C 13B 14C 15D 16B 17B
△
18.(12分)(1)2NaHCO3![]() Na2CO3+CO2↑+H2O
(2分)
Na2CO3+CO2↑+H2O
(2分)
(2)CO32-+2H+![]() CO2↑+H2O (2分)
CO2↑+H2O (2分)
②盐酸挥发出氯化氢气体;或CO2溶于水;或内外压强不等;或导管中的水未完全排出(答出任意两种即可)(2分)
③偏高(2分)
(3)①关闭酸式滴定管活塞,用手捂热烧瓶,若注射器活塞外移,松手后又回到原来位置,说明气密性良好。或关闭滴定管活塞,记下注射器活塞刻度,然后轻拉(推)活塞,松手后如果注射器活塞能回到原来位置,说明装置气密性良好。(2分)
②![]() 或
或 ![]()
![]() (2分)
(2分)
19. (4分)(1)还原 还原 (2)还原剂 还原
20. (6分)(1)Ba(NO3)2、Na2CO3 CuSO4 NaCl
(2)② BaCO3+2H+===Ba2++CO2↑+H2O
21.(10分)
(1)正极(2分) 电解
(2)2CuSO4+2H2O =======2Cu+O2↑+2H2SO4(2分)
(3)1 :1(2分)
(4)Ag(2分)
(5)Y极附近红褐色变深(2分)
22.(5分)(1)Na2O2 H2O NaOH (3分)
(2)2Na+2H2O=2Na++2OH-+H2↑ (1分)
(3)乙 (1分)
23. (5分)①A CH2=CH2 ; G --[--CH2—CHCl---]n-- (2分)
②----COOH(或羧基);(1分)
③加聚;(1分)
④ HOCH2CHO; (1分)
24(7)